平成15年度 国際的水銀汚染問題への対応に関する研究
有機水銀の健康影響に関する研究のレビュー
研究者 佐藤 洋(東北大学医学系研究科教授)
研究要旨
本研究では、「国際的水銀汚染問題への対応に関する研究」としては、まず、世界各地でどのような水銀汚染問題があるかを文献によって調査した。特に発展途上国における金採掘時の水銀汚染と環境保全についてレビューを行った。「有機水銀の健康影響に関する研究のレビュー」としては、感受性の高い胎児期曝露の生後の発育発達への影響を中心に据え、生涯の曝露も含めて健康影響について検討した。母親の食事由来の低濃度メチル水銀の胎児期曝露が、その後の児の発達に与える影響を検証する疫学的調査として良く知られている、デンマーク領フェロー出生コホート研究(Faroese Birth Cohort Study) とセイシェル小児発達研究(Seychelles Child Development Study: SCDS)の2つのコホート研究について概説した。また、実験動物におけるメチル水銀の健康影響・胎児期曝露影響についての研究報告も行った。さらに水銀蒸気の曝露源となりうるデンタルアマルガムの影響について、またワクチンに含まれるチメロサールの乳幼児への健康影響についても考察を行った。
キーワード:水銀汚染、メチル水銀、胎児期曝露、小児神経発達、デンタルアマルガム、チメロサール
研究協力者氏名
仲井邦彦(東北大学医学系研究科助教授), 亀尾聡美(東北大学医学系研究科助手),
永沼 章(東北大学薬学研究科教授), 村田勝敬(秋田大学医学部教授),
吉田 稔(聖マリアンナ医科大学助教授), 坂本峰至(国立水俣病研究センター部長),
嶽石美和子(秋田大学医学研究科大学院生),
岡 知子(東北大学医学系研究科・熊本大学医学研究科大学院生)
I 研究目的
メチル水銀による健康影響の全貌は科学的に明らかにはされていない。ことに低濃度曝露の影響については、閾値を含めて解明されておらず、比較的魚食の多い集団である日本人においても、魚類等に蓄積したメチル水銀曝露のハイリスクグループである胎児期曝露を受けた児の発育発達への長期的影響を明らかにする必要性は、高いと思われる。また水銀汚染問題は、国際的には金採掘・精錬にともなう水銀の放出があり水銀蒸気への作業者の曝露とその後の中毒を予防し、さらに水銀蒸気の放散による汚染の長期的影響、すなわち環境中でのメチル化と生態系での濃縮を防ぐ必要がある。これらの国際的な水銀汚染の実態を明らかにし、国際協力を中心とした効率の高い対応を創出することを目的とする。
Ⅱ 研究方法
「国際的水銀汚染問題への対応に関する研究」としては、まず、世界各地でどのような水銀汚染問題があるかを文献によって調査した。本年度は、メチル水銀の健康影響に関する文献調査も引き続き行った。前年までの研究班のメチル水銀の健康影響に関する文献レビューを見直し、文献の漏れが無いかを確認した。その後水銀汚染問題を報告している文献も含めて、Medline、Dialog等のデータベースから検索・収集した。「有機水銀の健康影響に関する研究のレビュー」としては、感受性の高い胎児期曝露の生後の発育発達への影響を中心に据え、生涯の曝露も含めて健康影響についての報告をレビューし、検討した。
(倫理面への配慮)
倫理面への配慮については、公開された文献の調査、及び調査の視察を中心とする研究であるので特に必要とは思われない。
Ⅲ 研究結果
Medline(1997-2003 年)を対象データベースとして、key words = mercury and pollutionで検索すると、191(71)論文がヒットした(カッコ内は今年度新規に検索されたもので内数)。また、key words = mercury & fetus/infant で検索すると248(81)論文がヒットした。そのうち、今年度の検索にて新規に抽出された文献を、別表-1、2(英文)に挙げる。日本語文献については、医学中央雑誌Web (医中誌Web) 版データベースから検索した。別表-3は、水銀汚染に関する論文のうち、キーワード=水銀&汚染にて検索されたもの、別表-4は、キーワード=水銀&小児/幼児/胎児にて検索されたものである。これらの文献と更に別の文献検索も加え、下記内容項目のレビューを行った。
*なお、別表-1~4の文献リストは、EndNoteファイル(Macにて作成)にて提供が可能です。
内容項目:
「国際的水銀汚染問題への対応に関する研究」
「有機水銀の健康影響に関する研究のレビュー」
「その他、水銀含有物による健康影響」
Ⅲ-1 発展途上国における金採掘の環境汚染と環境保全
水俣病が発生して以来、水銀による環境汚染に伴う健康被害は世界各国の大きな関心事になった。とくに、アマゾン川流域の水銀汚染はブラジルのみならず世界的に大きな社会問題となりつつある。この問題は金を抽出するときに使用される金属水銀が直接、環境中に放出され、その地域のみならず河川を汚染することである。しかも、水中で無機水銀からメチル水銀への有機化が起こり、食物連鎖を通じて魚介類への蓄積が生じる。このメチル水銀による汚染が食糧源を魚介類に依存するアマゾン川流域の住民に対し健康被害をもたらすと懸念されている1)。金採掘地域の水銀汚染はアマゾン川流域に留まらず、アフリカ、アジア、東欧の金産出国でも同様な問題を抱えている。
発展途上国での金採掘事業は手掘で、その多くは小規模金採掘地(図1)で行われている。手掘採掘は過酷な労働であるが、資本がなくとも容易に金の生産ができるため多くの労働者が従事し、金の抽出に大量の水銀が使用されている。ブラジルのアマゾン川支流のTapajos川流域やタンザニアのビクトリア湖周辺の小規模金採掘地における手掘による金の産出は、次のような手順で行われるが、そこには環境汚染のみならず様々な問題が存在している1)、2)。採掘した金鉱石を粉砕し、その後、粉末状の鉱石を水とともに絨毯を敷いてある木製の流し樋の斜面に沿って落下させる。この間に比重の大きい金粒子は絨毯の繊維の目の中に溜まり、軽い鉱物は流水によって流される。絨毯をはずし、溜まった金粒子をドラム缶内で洗い落とし、金の濃縮物を得る。鍋の中に金の濃縮物を入れ、さらに水銀を入れてアマルガムを形成させる(図2)。このアマルガムを綿布の上に置いたのち搾り、余分な水銀を取り除く。このような処理作業は一般に川を堰き止めて作った溜池や河川で行われ、河川の汚濁や水銀を含む尾鉱(選鉱屑)による水銀汚染が生じる。最後にアマルガムをバーナーで直接焼き、水銀を大気中に揮散させ、海綿金と呼ばれる粗金を得る。アマルガムの燃焼は屋内外で行われるため、大気中に蒸散した水銀蒸気は、生態系を汚染するのみならず、作業者自身も作業中に高濃度の水銀蒸気に曝露されることになる。
世界中に小規模金採掘地が点在しており、金採掘に使用される水銀が人為的な環境汚染の発生源として注目されている。しかしながら金採掘に関連する水銀汚染の実態や健康影響に関する報告はほとんどない。今回、南アメリカ、アフリカ、アジア、東欧の金産出国において水銀汚染や健康被害の現状そして環境保全対策に関する情報を得ることができたので紹介する。
南米諸国とくにアマゾン流域の金採掘地域
アマゾン河流域では1975年にゴールドラッシュが始まり、ブラジルだけでピーク時(1988年)には160万人以上にのぼる労働者が従事していた。この時期に周辺諸国のコロンビア、ペルー、ベネズエラ、ボリビア、ガイアナ、エクアドル、スリナムでも小規模金採掘地で採掘が行われている。
水銀は、スペイン植民地時代のメキシコ、ペルー、ボリビアにおいて、すでに鉱石からの金や銀を得るために大量に使用されている。1550~1880年には、20万トンに及ぶ水銀が、南アメリカのスペイン植民地領で環境中へ放出されたと試算されている3)。過去30年間に南米の金採掘地から放出された水銀量は3,000~5,000トンで、その60~80%はブラジルである。そのうち30~45%は大気中へ放出され、生態系に水銀蓄積をもたらしたと考えられているがその実態は調べられていない。その後の調査では金採掘地周辺の大気および土壌中の水銀測定で、水銀は大気中の粒子状物質への沈着や降雨により、周辺地域に蓄積していないことが明らかになっている。水系へ流出した金属水銀は比較的安定であるので自然界で他の金属とアマルガムを生成し、底質に蓄積する4)。
アマゾン川流域の土壌中水銀濃度は高いが、それは人間活動(特に金鉱採掘)よる放出や古代地質形成に起因しており、流域では水銀濃度にばらつきが見られる。Tapajos川、Madeira川、Negro川流域における大気、土壌、底質、浮遊物、および水質および生体試料(尿、血液、毛髪)中の水銀を測定した結果では、Madeira川流域の土壌は50ppb前後の水銀レベルであるが、フランス領ギアナ及びNegro川、 Tapajos川流域の土壌から100-300 ppbの水銀が検出されている3)。堆積物の水銀濃度を金採掘によって生じる水銀汚染の環境モニタリングに使用していたが、金属水銀は不均一に分布することから水銀汚染のモニタリングの指標としては不適切であることが明らかとなった。むしろダムの堆積物を採取する方法がより実用的であることが判明した。Tucuruiダムでは、ダムの上流140kmに渡って水銀が検出され、ダム付近が最も高い濃度(~200ppb)であり、この値はダム上流の地点よりも平均で4-5倍高い。金鉱採掘地区では作業者の尿中水銀濃度が1,000 μg/l以上であったので、高濃度の水銀蒸気に曝露されていたはずが、作業環境の改善や換気設備の設置により、が10~50 μg/lに低下した3)。
水中では無機水銀からメチル水銀への変換が起こり、メチル水銀は食物連鎖を通じ、魚介類に濃縮される。その結果、魚介類を主食とする地元の住民はメチル水銀に曝露される。魚介類の水銀濃度は生息する川によって異なる。Tapajos川下流では魚介類の水銀濃度は減少傾向にあるが、Negro川やMaderia川では水銀濃度に減少傾向が見られない。TucuruiダムやTapajos川水系の魚介類の総水銀量は、ほとんどがWHO基準値0.5ppmを越えており、中には2ppmを越える魚介類もいた。食物連鎖によりメチル水銀が蓄積するため総水銀に対するメチル水銀の割合はほぼ100%と極めて高値である5)。Negro川流域には金採掘現場は存在しないが、この川で捕獲された魚介類から高濃度の水銀が検出されている。Tucuruiダムでは、貯水開始から5年後に高濃度の水銀が魚介類やダム周辺の住民の毛髪から検出されている6), 7)。しかし、最初の調査で採取した5種類の魚介類と同種を再び10年後に採取したところ、水銀濃度は1/2から1/3へ減少していた。BalbinaおよびSamuelダムで採取された魚介類の水銀濃度はTucuruiダムの魚介類の値よりも低い。アマゾン河流域では新設ダムの建設が幾つか計画されており、ダム建設によって起る生態系の水銀汚染には注意すべきである。
流域住民の健康調査では、メチル水銀の曝露は決して低くはなく、毛髪中水銀濃度は魚介類の摂取量と強い関連性を示し、摂取量の相違により村落や家族の中で大きなばらつきが見られている。流域住民の毛髪中水銀濃度は平均で10から30ppmで、中には150ppmを超えるヒトもいた。金の採掘、精錬、取引に従事している作業者は水銀蒸気に曝露され、流域住民はメチル水銀に曝露されている5)。神経生理学的検査により軽度な健康影響が観察されたが、メチル水銀曝露によるものかは明らかではない。その理由はアマゾンでは昆虫を媒介としたマラリアがよく発生し、その駆除に使用される殺虫剤やマラリア治療薬が交絡因子となっているからである。
しかし、アマゾン川流域の住民のうちとくに妊娠中または妊娠を希望している女性に対し、多量の魚介類の摂取を警告するととともに、高濃度の水銀に汚染されていると思われる地域において新たな環境モニタリングや健康調査を早期に実施する必要がある。
アフリカ諸国の金採掘地域
アフリカにおける手掘作業で行っている小規模金採地掘周辺の水銀汚染の実情とその影響については、ゴールドラッシュが始まって20年を経過したが現在でも、ほとんど把握されてはいない。アフリカでは約300~370万人の人々が小規模鉱山に生活の糧を依存し、その多くは金採掘に従事している。アフリカ諸国における金採掘に起因する水銀汚染およびその影響に関しては、ガーナ、タンザニア、ジンバブエ、モザンビーク、ケニアで幾つかの報告がなされている。それ以外の金産出国では水銀汚染に関する情報がない。
ガーナの年間金産出高は 45トン以上、その大部分は中規模から大規模な金採掘で産出されている。この国でも約4万人の季節労働者が小規模金採掘地で働き、大量の水銀を使用している。ガーナ南西のAnkobra川およびTano川流域の魚介類の総水銀を測定した結果、水銀濃度は湿重量当り0.01~2.50 ppmで、9.3%の魚介類がWHOの定めた基準値0.5 ppm を超えている8)。小規模金採掘労働者の水銀曝露量は高く、血中水銀濃度は金採掘労働者50 名のうち、24%が3~50 ng/g、68%が50~500 ng/g、8%が200 ng/gを越えている。尿中水銀濃度は被験者の26%が健康影響に基づく職業性水銀曝露の尿中最大水銀濃度の限界値の50μg/lを上回っている8)。小規模金採掘地区の住民の毛髪(平均4.27 ppm)や爪(平均2.65 ppm)の水銀濃度も一般住民に比べて高い。
タンザニアにおける小規模金採掘の操業は 1980年代から1992年にピークを迎え、今日では減少している。ゴールドラッシュ時には約20~30万の人々が金採掘に従事している。小規模金採掘地で産出される金は、公式の発表によると1992 年までに4 トン以上に達している。金の産出量から水銀消費量を試算すると、1992年までに約8トンである。ダルエスサラーム大学の地質学部がスウェーデン調査協力庁(SAREC)の援助を得て1992-1997年に行った調査では、タンザニアの金採掘地域の水銀汚染は一様ではない。バックグラウンド値を1 として水銀汚染の程度を比較すると、底質で1-140、水銀-金アマルガム燃焼作業を行っている周辺の土壌は特に高く90-600である9)。ビクトリア湖周辺、LupaそしてMpanda金採掘地区の総水銀濃度は、表層水では0.01-6.8μg/l、底質では0.01~140 ppm(乾燥重量)、土壌では0.05~28 ppm、尾鉱(選鉱屑)では0.04-31ppmである。ビクトリア湖周辺の金採掘地域で水銀アマルガムの燃焼を行っている作業者の尿中水銀濃度(平均240μg/l)は、水銀曝露を受けない鉱山労働者(2.6μg/l)および採掘地域外の住民(2.3μg/l)と比較するとかなり高い。魚介類中の水銀濃度を鉱山地域に近いビクトリア湖南部の3箇所で測定した結果では、乾重量0.05ppm以下と低い。金採掘地域住民(平均1.5 ppm)およびビクトリア湖周辺漁民(平均0.3ppm)の毛髪水銀も低い。苔類によるバイオモニタリング調査では、バックグラウンド値が0.10ppmに対し、Mugusu金採掘地周辺のウメノキゴケ属(Parmelia)では0.21~3.10ppm と高濃度の水銀が検出されている10)。
ジンバブエでは、約20万人が小規模金採掘に従事している11)。この国では金1kgの生産に対し約1.2~1.5kgの金属水銀が使用され、回収されずに環境へ放出される。金属水銀の70-80%はアマルガム加熱よって大気中へ放出され、20~30%が尾鉱、土壌、水質中に放出される。Tafuna Hill金採鉱地周辺の底質から、0.7 ppm (乾燥重量)の高濃度の水銀が検出されている。金採鉱地周辺の河川水の水銀濃度(0.02~0.65μg/l)は一般の河川水の水銀濃度(0.01~0.02μg/l)に比べると高濃度である。
モザンビークの Manica金採掘地区で手掘作業従事者は、1万人を超える。この国でも金抽出に使用した水銀はほとんど回収されずに環境に放出されている。ケニア東部のLongarianおよびMacalda 金採掘地区から採掘された金鉱石は違法に処理されている。そのため、水質中の水銀濃度は0.6~12μg/l、アマルガム処理を行う室内の水銀濃度は146-430μg/m3、手掘採掘作業者の尿中水銀濃度は43-127μg/l と極めて高濃度である。
アフリカの多くの金産出国では、金採掘にともなう水銀汚染による生態系への影響が深刻であることをほとんど認識していない。現在、アフリカにおける調査データは極めて少なく、水銀汚染の程度そして汚染による生態系およびヒトへの影響に関する評価は不十分である。いくつか事例として職業性水銀蒸気曝露が作業者へ重大な健康影響をもたらしていると報告されているが、金採掘地や河川流域の住民のメチル水銀による曝露程度は未だ明らかではない。アフリカの水銀汚染問題およびその汚染が生態系とヒトに及ぼす健康影響を適切に評価するためも、国際的な共同調査が必要である。
東欧諸国の金採掘地域
東欧および独立国家共同体(CIS)諸国の主要金採掘地おける金産出量は285トンで、これは2000年における世界産出量の11%を占める。ロシア連邦、ウズベキスタン、キルギス共和国は世界の金産出国の上位20ヶ国に入る。CISおよび東欧の金生産国で昔から採掘している金採掘地域では、世界の金採掘地と同様に水銀汚染の問題を抱えている。しかし、水銀汚染に関する調査は費用が掛かるため行われておらず、多くの国では水銀汚染に対する解決の見通しは全くたっていない。
金採掘に使用した水銀量に関するデータは旧ソビエト連邦には残っていない。当時の金採掘技術が今日と同様であることから、環境中に放出された水銀量は金産出量および保有量から推定できる(表1)。ロシアの金産出量は、ソビエト連邦時代を含む270年間(1719~1990)の間の産出量9,752トンを合わせると14,030トンにも及ぶ。ロシアでは、1990年の法的規制が行われるまで、金の抽出にアマルガム法が用いられていた。大企業ではアマルガムの加熱によって蒸発する水銀の回収が義務づけられていたが、技術的に100%水銀を回収することは不可能であった。水銀の蒸散が特に大きかったのは小規模金採掘地である。ソビエト連邦時代、国家の厳しい管理下にあった頃、金の抽出おける水銀消費量および消失量に対し、厳しい規準が設けられている。例えば、アマルガム洗浄の際に流し樋に設けられている回収装置での水銀消失は10%であった。金鉱の採掘から精錬まで技法の相違により、水銀消費量と金産出量の比は6~10:1から1:4まで大きく変わる。極東の金採掘地域の公文書によると、1960-70 年代おける水銀消失は金1トンの生産に対し0.5~1トンであったことが記載されている12)。さらに、浚渫機や洗浄装置で回収不能になった水銀は年間6トンで、金抽出工場では年間およそ3トンに達している13)。おそらく回収不能な水銀は報告された値より多いと思われる。
旧社会主義圏諸国でも行政および経済改革が行われたときに多くの記録文書が消失しており、金鉱で使用された水銀量の把握が出来ない。表1は環境中に放出された水銀の推定値である。水銀汚染はアマルガム処理以外に、金を含んだ岩石、鉱石、砂利に含まれる天然の水銀によっても起る14)。従って、ロシアおよび旧ソ連ではこれまでに行われた金採掘作業により環境中に放出された推定水銀量は7,200トンになり、うち5,800トンはアマルガム処理、1,400トンは金を含む岩石、鉱石、砂からの抽出に使用されたと推測される。
現在、金採掘地における水銀放出発生源は、主に金鉱石を選鉱したのちに排出する大量の尾鉱堆積物である。この尾鉱堆積物から再び金を回収するために大量の水銀が使用されるため、水銀汚染は増大することになる。金採掘地域における生態系および居住地域における水銀の汚染が明らかになりつつある。シベリアおよび極東での金採掘地域で最も深刻な水銀汚染は直接水銀を利用している金抽出工場の周辺である。環境中の水銀含有量は土壌では18.9ppm、地下水では3280ng/l、河川水では40ng/l、底質では54.2ppmである。金-水銀アマルガムの形成およびアマルガムの加熱が行われる作業場の空気中水銀濃度は、許容濃度の50倍を越える。また古い金抽出工場周辺の土壌や尾鉱堆積物から1,000~2,000ppmと、高濃度の水銀が検出されている。このように、シベリア、ウラル、極東における過去そして現在の金採掘地および居住地域の多くは水銀に汚染されている。
シベリアおよび極東の厳しい気候条件(広大な永久凍土、冬季における土壌の凍結や河川、湖沼の凍結)では、暑く乾燥した地域に比べ、水銀汚染は局在化する。水銀による環境汚染と健康影響を考える上で、様々な気候条件下での水銀のメチル化は重要な問題である。この点を明らかにするには広範囲に渡る現地調査が必要であり、加えて金採掘地域における環境改善のための、各国政府等による予算の確保が強く求められている。
アジア諸国の金採掘地域
アジアでは、経済を小規模鉱山に依存している国は少なくなく、そのため経済開発および産業化が環境にもたらす負担は大きい。国際労働機関(ILO)では小規模鉱山を、雇用労働者50人以下(表2)、250,000トン以下の鉱石の産出、機械化の割合、金鉱の規模に基づいて定義している。これら小規模鉱山には違法に採掘を行っているところもある。
インドネシアの金採掘地域
インドネシアでは、小規模金採掘地は国中に点在し、大規模鉱山企業の下で金採掘が行われている。最近の調査では、金採掘地の周辺地域に対して金採掘に使用される水銀から発生した水銀蒸気が風雨によって運ばれ水路や河川が水銀により汚染され、金採掘作業者のみならず周辺地域住民に水銀被害をもらす危険性が存在することが明らかになってきた。カリマンタン島では、金1gの抽出に対し、約1gの水銀が大気中へ放出される。現在インドネシアの金鉱山で使用されている総水銀量は、年間6~48トンである。Pongkor(Java東部)の金採掘地域で実施した調査では、アマルガム製法から毎月放出される水銀量は0.5kg であることが明らかにされた15)。アマルガム製法で金の精錬を行っている2,000ヶ所の地点から、年間12トンの水銀が環境中に放出されると推測される。
1996 年にカリマンタン西部において、金採掘地下流のKapuas川の水質中の総水銀濃度は0.8~1.2 μg/l(平均値1.02 μg/l)で、河川の底質に含まれる水銀濃度は0.13~0.33ppm(平均値0.19ppm)である16)。Java中部のDonan川のマングローブ生息地の最近の水質調査では、水銀濃度は0. 70 μg/l~3.12 μg/l である17)。Pongkorの金採掘地域で行った調査では、河川の水質中の水銀濃度は2.5 μg/l で、川の底質の水銀濃度は最も高いところで2,688ppmであった18)。2001年には、この地域のBantar Karet村およびMalasari村の上水に高濃度の水銀が検出された。Pongkor地域を流れるCikaniki川の水質中の水銀濃度は0.14~0.55μg/l、堆積物中からは3.58~28.4 ppmの水銀濃度が検出された19)。これらの値は、Sulawesi島のTotok川の堆積物中の水銀濃度が2.48~78.9 ppmに比べ低い。Sulawesi島では、Newmont Minahasa鉱業会社が海底約80mに尾鉱を直接投棄していた。浅瀬への尾鉱の海洋投棄は酸性の岩石と地表水により水生生物を死滅させる可能性が懸念される。Pongkor地域では、土壌中の水銀濃度は1300ppmにまで達している。Pongkor金採掘地から排出された尾鉱には615~1,058ppmの水銀が含まれている。また、インドネシアがアジアとオーストラリアの2つの大陸およびインド洋と太平洋の2つの海洋の間に位置しているため、国際水域に対する水銀汚染が大きな脅威となりつつある。
インドネシア金採掘地域では、食物連鎖の水銀汚染が進行していることが明らかになった。1999年に行った調査では、Pongkor地域の野菜および果物中の水銀濃度は0.04ppmを超えていることが判明した。Sulawesi島のTotok川河口に関する報告では、甲殻類から0.86ppm、その他の魚類から0.58 ppmの水銀濃度が測定されており、これらの値はWHOが定めた許容範囲の0.5 ppmを超えている。Kambeyらは、Sulawesi北部の魚介類の平均水銀濃度が2.08±0.38 ppmであると報告している20)。Pongkor金採掘地区の労働者に、ひりひりする痛み、しびれ、指の脱力といった自覚症状を訴える作業者もいる。1998年に3000人だった採掘労働者が1999年に7000人に増加しており、金採掘地域での水銀使用量も増加している。インドネシア環境フォーラム(Walhi)が詳細な調査を行ったところ、金採掘地域周辺の住民20名の血液中水銀濃度は2.6~10.0μg/l(平均値5.98±2.25μg/l )であった20)。
現在、インドネシアでは水銀使用に規制はない。金採掘での大量の使用は労働者の環境汚染に対する意識不足や経済的な困窮がこの国のおける水銀汚染の根底にある。Ratatotok金採掘地域の労働者34%に水銀中毒の徴候が見られるにもかかわらず、水銀中毒の危険性に対する認識がなく、しかも無関心である。とくに若年労働者には、“自分は若いので水銀によるいかなる悪い影響にも耐えられる”と述べたものもいる。
インドネシア国内での金採掘に伴う水銀の使用量の増加は、地域社会に対する水銀汚染の拡大をもたらし、このことがこの国の新たな病巣と成りつつある。それゆえ、緊急な水銀汚染の実態調査が必要である。さらにインドネシアが現在直面している水銀問題以外に、国際水域に対する海洋汚染の危険性についても考慮すべきである。
インドネシアを除く主要アジア諸国の金採掘地域
中国における 1996年の金産出量(173トン)のうち、アマルガムによる金の抽出法で13%が生産されており、金鉱石1トンに対し平均146gの水銀が使用されている。水銀総使用量のうち25%に相当する20トンが回収されずに環境中に放出されている。とくに個人が所有している小規模金採掘地は水銀放出の重大な人為的発生源である21)。近年、水銀を用いた小規模金採掘は政府により禁止されたため、金鉱からの水銀放出は今後大幅に減少すると期待されている。金の産出量は世界第3位であり、1960~1989年の間では、年間の水銀産出量は約1,000トンであったが、金採掘に対する水銀使用が禁止されたのち水銀使用量は年間600~650トンに減少している。
フィリピンでは南部の小規模金採掘地での採掘労働者は、1980年代のゴールドラッシュのときには10万人に達した。金採掘により、年間26トンほどの水銀が廃棄され、それらは豊富な漁場とされているAgusan川、Butuan湾、Davao湾に流出している。調査を行った結果、底質中の総水銀濃度は乾燥重量当り0.553~66.5 ppmであり、河川水からは72.8~78.4 ng/mlが検出されている。魚介類からは高濃度の水銀が検出され、水銀のほとんどがメチル水銀であった。5~17歳の児童162人の毛髪総水銀量は0.28~20.4 ppmであり、メチル水銀の割合は46.0~99.8%であった。血中総水銀濃度は0.76~56.9 μg /lであり、血中メチル水銀濃度は1.36~46.7 μg/lであった。児童を対象に行った健康診断では、低身長、低体重、歯肉の褪色、腺症、皮膚異常が主な所見であった。国連工業開発機構(UNIDO)が行った調査では、金採掘労働者(N=102)の7割が水銀蒸気曝露による慢性中毒に罹患しており、とくにアマルガム処理に携わる作業者の8割が罹患していた。臨床症状として、企図振戦が主で瞼、唇、指の軽い震え、運動失調、知覚障害、歯茎の蒼白などの異常所見が出現している。
アジアの小規模金採掘地で金採掘を操業している国々では、健康、安全、環境、労働条件などの深刻な問題が報告されている。アマルガム加熱によって発生する水銀蒸気を回収するためのレトルトなどはアジア諸国ではまだ普及していない。また小規模金採掘地で多くの事故が発生しているにもかかわらずほとんど調査されていない。小規模金採掘地では労働者の健康問題は、鉱石の採掘や精錬にともなう作業環境の対策に加えて地域社会における上水道の不備、マラリア、チフス、赤痢、性感染症(エイズを含む)、栄養失調、薬物乱用などについての対策を同時に考慮しなければならない。
小規模金採掘により金採掘周辺の河川およびその支流は汚染されるだけでなく酪農/畜産業および農産物への悪影響を及ぼす。河川の汚染は魚介類の死滅を招く。森林の伐採は表土を剥ぎ取り、鉱石処理に多量の水が使用されるため一般家庭用の水が枯渇する。一方、自然界に放出された水銀はメチル水銀に変換し、水系の食物連鎖を通して、やがて魚類その他の生物の中で生物濃縮される。従って、金採掘地域周辺の住む労働者や住民はアマルガムから金を回収するときの水銀蒸気曝露に加えて、食糧としてのメチル水銀に汚染された魚介類の摂取によるメチル水銀曝露が懸念される。
おわりに
南アメリカ、アフリカ、東欧、アジアの金産出国における金採鉱は小規模金採掘地での手掘作業に依存するところが大きい。小規模金採鉱はその国の経済を支えるとともに多くの人々に職を提供し、生計を支えているが、国家や大企業の管理下で必ずしも適正に行われておらず、その多くは違法な採掘である。これらの国々では金鉱石からの金の抽出に大量な金属水銀を使用している。しかしながら、その水銀は回収されることなく環境中に放出され、生態系が水銀で汚染される。大気中に放出する水銀を削減するためにはレトルト装置による水銀の回収そして再利用することが小規模金採掘地における重要な対策となるが、ほとんどの国で実施されていない。さらに金鉱石処理に利用された大量の廃水や水銀を含む尾鉱が河川や海洋に廃棄され、水質汚濁や水銀汚染を引き起こしている。環境中への水銀放出を削減させるため対策として、小規模金採掘作業者の環境保全に対する意識の向上とそのための啓蒙活動が重要である。水銀汚染は河川に留まらず、魚介類の水銀汚染を引き起こし、魚介類を食糧源とする河川流域住民にメチル水銀による健康被害をもたらすことがありえる。すでに住民の毛髪中水銀濃度が高いことから、早急な健康被害の把握とその予防対策を実施する必要性に迫られている。また水銀を直接取り扱う金採掘作業者も高濃度の水銀蒸気に曝露されている。アマルガム処理を行う作業者が慢性無機水銀中毒に罹患しているとの報告が一部の国でなされているが、多くの国では職業性水銀蒸気曝露による健康障害に関する調査は行われておらず、その実態は不明である。
今後、世界各国に点在する小規模金採掘地域における水銀汚染の環境モニタリングの継続的な実施と金採掘作業者ならびに水銀アマルガムの加熱処理作業者の水銀蒸気よる健康被害の調査と実態把握が急務であろう。
引用文献
- 赤木洋勝:アマゾン河流域の水銀汚染、衛生化学、41:107-115,1995
- 吉田稔、赤木洋勝:タンザニア・ビクトリア湖周辺の金採掘現場における環境問題、公衆衛生、 67:795-798、2003
- Nriagu, J.O.: Mercury pollution from the past mining of gold and silver in the America, Sci. Tol. Environ. 149:167-181,1994
- Lacerda, L.D., Pfeiffer, W.C., Marins, R.V., Rodirigues, S., Souza, C.M.M. & Bastors, W.R.: Mercury disporsal in water, sediments and aquatic biota of a gold mining tailing deposit drainage in Poconé, Brazil. Water, Air and Soil Pollution, 55:283-294, 1991.
- Akagi, H., Malm, O., Kinjo, Y., Harada, M., Branches, F., Pfeiffer W.C. & Kato, H.: Methylmercury pollution in the Amazon, Brazil, Sci. Total. Enviorn. 175: 85-95, 1995.
- Porvari, P.: Mercury levels of fish in Tucuruí hydroelectric reservoir and in River Mojú in Amazonia , in the sate of Pará, Brazil. Sci. Total. Enviorn. 175: 109-117, 1995.
- Leino, T., & Lodenius, M.: Human hair mercury levels in Tucuruí area State of Pará, Brazil. Sci. Total. Enviorn. 175: 119-125, 1995. http://www.ncbi.nlm.nih.gov/pubmed/8560241
- Adimado, A.A & Baah, H.: Mercury in human blood, urine, hair, nail, and fish from the Ankobra and Tano River basins in Southwestern Ghana. Bull. Environ. Contam. Toxicol. 68:339-346, 2002. http://www.ncbi.nlm.nih.gov/pubmed/11993807
- Ikingura, J.R.: Mercury pollution due to small-scale gold mining in Tanzanian goldfields, in Lars Landner (ed): Small-scale Mining in African Countries-Prospects, Policy and Environmental Impacts. CM Gruppen AB, Bromma Sweden; 143-158, 1998.
- Ikingura, J.R. & Akagi, H.: Lichens as a good bioindicator for air pollution by mercury in small-scale gold mining areas, Tanzania. Bull. Enviorn. Contam. Toxicol. 68:699-704. 2002. http://www.ncbi.nlm.nih.gov/pubmed/12068936
- Van Staaten, P.: Mercury contamination associated with small-scale gold mining in Tanzania and Zimbabwe. Sci. Tot. Environ. 259:105-113. 2000. http://www.ncbi.nlm.nih.gov/pubmed/11032140
- Koval, A.T., Sidorov, Y.F. Nagorny. V.A. & Ostapchuk V.I.: Industrial pollution of metallic mercury on gold mining sites of the Amur and the Khabarovsk Regions. In: Gold mining. Problems and perspectives. Khabarovk, pp.347-352, 1997.
- Laperdina, T.G., Melnikova, M.V. Koval, A.T., Sidorov Y.F., Nagorny. V.A. & Ostapchuk, V.I.: Gold mining in Siberia and the Far East as a source of mercury contamination of the environment. J. Environ. Sci. 12:51-58, 2000.
- Roslyakov N.A. & Kirikkova, O.V.: Environmental contamination by mercury owing to gold production in Russia. Chemistry for sustainable development, 3:41-52, 1995
- Supriyanto, I., Soesanto, S., & Tugaswati, T.: Environmental and Health Impacts of Hg on Traditional Gold mining Process in Gunung Pongkor, Bogor. National Institute for Health Research and Development, Ministry of Health. 2001
- Edvantoro, B. B., Rahman, A., Damaerius, & Ratnaningsih, D.: Mercury Concentration along the Kapuas River in West Kall'mantan. In the Proceedings of the International Workshop on the Fate of Mercury in Gold-mining and Measures to Control the Environmental Pollution in Various Countries. pp. 61-70. National Institute for Minamata Disease, Faculty of Public Health University of Indonesia, Pusarpedal, Serpong, Indonesia.1996.
- Pagoray, H.: Mercury and Cadmium Contents Alongside of Donan River Bank of Industrial Area, Calacap (Kandungan Merkuri dan Kadmium sepanjang Kahli Donan Kawasan Industri Cilacap. In: Frontir no.33 (in Indonesian). 2001.
- Gunradi, R., Sukmana, Ta'in, Z., & Nixon. : Report on the Investigation of Hg (mercury) Monitoring by Geochemistry Mapping in the Area of Illegal Gold Mining in Pongkor, West Jawa (Laporan Penyelidikan Pemantauan Unsur Hg (mercury) akibat Penambangan Emas Tanpa Ijin (PETI) di Daerah Pongkor, Jawa Barat, dengan Pemetaan Geokimia). Koordinator Urusan Departemen Energi dan Sunberdaya Mineral, Propinsi Jawa Barat (in Indonesian). 2000.
- Kambey, J. L., Farrell, A. P., Bendell-Young, L.: Influence of illegal gold miming on mercury levels in fish of North Sulawesi 's Minahasa Peninsula, (Indonesia). In: Environmental Pollution 1 14 (2001) 299-302. 2001.
- WALHI (Indonesian Forum for Environment): Health Examination Program of the Community& in B2yat (A Report). Wahana Lingkungan Hidup Eksekutif Nasional, Jakarta (Indonesian). 2002.
- Lin, Y., Guo, M. & Gan, W.: Mercury pollution from small gold mines in China. Water, Air and Soil Pollution, 97:233-239, 1997.
- その他の資料提供者: Dr.J.R.Ikingurara (Tanzania)、Dr. Olaf Malm (Brazil)、Dr. Xinbin Feng (China)、Dr. Nelia P. Cortes-Maramba & Dr. Trinidad T. Francisco-Riverva (Philippines) Dr. Tatyana G. Laperdina (Russia) Dr. dr. Rachmadhi Purwana SKM (Indonesia)


| 年代 | |||||
|---|---|---|---|---|---|
| 1719-1917 | 1917-1990a | 1991-1995 | 1996-2001 | 合計 | |
| a:旧ソ連の全ての国を含む | |||||
| 金産出高(トン) | 2754.13 | 9752 | 738.2 | 785.9 | 14030.23 |
| 水銀消失量(トン)と金産出高(トン)の関係 | 0.75:1 | 0.5:1 0.25:1 |
0.05:1 | 0.025:1 | |
| アマルガム処理時の水銀消失量の推定値(トン) | 2065 | 3680 | 37 | 20 | 5800 |
| 金を含む岩石・鉱石から抽出される水銀の推定値(トン) | 275 | 975 | 75 | 80 | 1400 |
| 総水銀放出量(トン) | 7200 | ||||
| 国名 | 鉱山数 | 違法採掘(%) | 雇用者数 |
|---|---|---|---|
| 中国 | 250,000 | 80 | 4,300,000 |
| インド | >10,000 | 10 - 60 | 1,000,000 - 1,100,000 |
| インドネシア | 77,000 | - | 300,000 - 500,000 |
| パプアニューギニア | - | - | 15,000 - 20,000 |
| フィリピン | 700 | 80 | 200,000 |
| タイ | 500 - 950 | 5 | 21,500 |
| ベトナム | 500 - 600 | 0 | 35,000 - 45,000 |
Ⅲ-2 フェロー諸島における出生コホート研究
フェロー出生コホート研究(Faroese Birth Cohort Study)は、メチル水銀の小児神経発達影響に関する研究として世界的に有名である。この理由は、米国科学アカデミーが米国環境保護庁(EPA)のメチル水銀に関する基準摂取量(RfD)を再検討する際に参照すべき重要な研究であると結論したことにある。本稿は、北大西洋に浮かぶ18の島々からなるフェロー諸島が環境科学領域の研究対象集団として何故選択されたのか、そこで検査された7歳児および14歳児からどのような研究成果が得られたのか、そしてリスク評価の過程でフェロー諸島にどのような変化がもたらされたのかについて概説した。また、この出生コホート研究の解析過程で吟味された“リスクの過小評価”についても触れた。
1. 研究目的
「フェロー諸島」は、メチル水銀やポリ塩化ビフェニル(PCB)を巡る話題に関心があれば、環境科学の世界で知らない者がいないくらい有名になった。この直接の原因は2000年7月11日付け全米科学アカデミー(NAS)諮問委員会によって発表された結論「米国環境保護庁(EPA)はメチル水銀の摂取基準量(この量以下であれば毎日摂取しても人体影響を生じないとする値RfD)の見直しのための“重要な研究”としてフェロー諸島の研究を利用すべきである」による1)。この発表当初、フェロー出生コホート研究(Faroese Birth Cohort Study)は地味な学術専門誌2,3) にしか掲載されておらず、有名雑誌に幾つか掲載されたセイシェル小児発達研究4-6) が選ばれなかったことに疑義が唱えられた。その細部はともかく、日本からフェロー諸島まで行くとすれば最短で約15時間要する。デンマークのコペンハーゲンからフェロー諸島へは飛行機で約2時間であるが、デンマークとフェロー諸島の間には1時間の時差があり、地理学的にもデンマークの一部とは思えない素朴な自然がある7)。フェロー諸島は西欧諸国の中で独自の食文化および言語を持つがゆえにメチル水銀やPCBの研究対象の地として脚光を浴びたのである。
本研究では、フェロー諸島の自然、歴史および食文化を概括するとともに、何故フェロー諸島でコホート研究が行われたのか述べる。そして、フェロー出生コホートの主要な調査結果を要約し、さらに現地のメチル水銀に関する公衆衛生活動に触れ、最後にメチル水銀のリスク管理の在り方を述べる。
2. 研究方法
1997年までのフェロー出生コホート研究に関する論文を既にレビューしたが、個々の結果はその後の発表論文と密接に関連していることから、1992年以降の論文を再整理し、一貫性のある形でレビューし直した。文献は、主任研究者であるGrandjean教授らのホームページに掲載されている論文を参照した。
3. 研究結果と考察
A.フェロー諸島の自然と歴史
フェロー諸島は、北大西洋のノルウェーとアイスランドのほぼ真ん中、デンマークとアイスランドを結ぶ線上の北緯62度に位置する18群島からなるデンマーク自治領である。フェロー諸島(Føroyar)とはフェロー語で「羊の島」という意味である。人口は約47,000人(羊は約10万匹)で、首府Tórshavnには約19,000人が住んでいる。
フェロー諸島は北大西洋の海底火山帯の一部が海面に姿を現したもので、島全体が溶岩でできている火山帯特有の地勢である。島の多くに古い溶岩流の痕とともに、氷河で削られたフィヨルド地形も見られる(図1)。フェロー諸島は近海にメキシコ湾流が流れているために、緯度の割に気候は温和で、海岸では冬氷点下5℃に達することは少ない(冬の平均気温は3℃)。夏至の頃は夜が非常に短い。また、北の海の特徴とも言えるが、天候の変化が激しく、一日のうちで雪が降ったかと思うと晴れたり、そのまた後には雨が降ったりとめまぐるしく変わり、1年の3分の2は雨、霧、雪である。
この地に人が住むようになったのは9世紀であり、ノルウェー人か当時ヨーロッパ各地に侵寇していたヴァイキングが住み着いた。1380年にノルウェーの統治下に入り、1814年のキール条約によってデンマーク領となった。1948年にデンマークから自治が認められ、自治領となった。現在、防衛などごくわずかな分野を除いて完全に自治権を有し、デンマーク議会に定数2を持っている。
フェロー諸島は、中世以後20世紀初めにかけて大陸から孤立していた。このため、長年にわたって独自の文化を築いてきた。とりわけ言語は、アイスランドと同じように古い北欧語の特徴を残している。また、狭い島内が文化圏であったこともあり、島民の全員参加に近い独特な議会制度が維持された。
B.フェロー諸島における捕鯨
フェロー諸島の捕鯨は、国際捕鯨委員会から捕鯨を認められている共同体レベルの非商業的行為である。フェロー諸島の人々は1000年以上前に海洋哺乳類を狩猟する伝統をもった古代スカンジナビア人移住者の末裔であり、この捕鯨はフェロー諸島に人が住み着いてからまもなく始まったと考えられている。長年にわたるゴンドウ鯨の平均年間捕獲量は850頭である。鯨の捕獲に当たってフェロー諸島は9つの地区に分けられ、鯨を追い込む条件を満たす22の砂浜での操業が許可されている。各地区では漁をそれぞれの地区官庁が管理し、許可された各々の砂浜に4名の現場監督が選出される。捕鯨の規則には、鯨をどのように捕殺し、どういう道具を用いて良いかが明記されている。捕鯨は鯨の群れが陸地近くで目撃され、海面や天気の状況が問題ない場合にのみ行われる(図2)。職場の雇用者は、労働者が捕鯨に参加するために休むことを認めている。捕獲された鯨は、各地区の複雑な伝統的分配方式に則り、捕鯨が行われた砂浜の地区住民と漁に参加した人に分配される。また、病院や個人医院、デイケアセンターにも分配されるのが慣例となっている。ゴンドウ鯨の肉や脂身は、冷蔵庫で保存されたり、伝統的な塩漬けにして屋外で乾したりし、調理される。
1990年代前半のフェロー諸島で採れたゴンドウ鯨に含まれる平均水銀濃度は3.3 μg/g(このうち約半分がメチル水銀)、鱈で0.07 μg/g(大半がメチル水銀)であった。この調査より、成人の鯨肉の平均摂取量は12 g/日、魚肉は72 g/日であり、平均水銀摂取量は約36 μg/日と推定された8)。また、鯨の脂身はPCBの主要な摂取源となっていた。
C.フェロー諸島における水銀調査
1980年代半ばにフェロー諸島で水銀に関する予備調査が行われた。小漁村に住む妊娠可能な女性(20~50歳)53名の血中水銀濃度の中央値は12.1(範囲2.6~50.1)μg/l であり、デンマーク本土女性の中央値1.6 μg/l の約8倍であった。このため、本格的な水銀調査が1986年3月1日から1987年12月末までOdense大学環境医学教室のGrandjean教授とフェロー諸島のWeihe病院部長を中心として行われた。この期間に出産した母親のうち、毛髪および胎盤が採取でき、かつ妊娠経過、妊娠中の鯨および魚の摂取量、飲酒・喫煙等の質問紙調査ができた1,022名(全体の75.1%)が母子コホートとして登録された2,8)。フェロー諸島が研究対象集団として選ばれた理由は、①病院制度や社会保障制度等が北欧社会と同じである(研究結果の一般化が容易)、②フェロー諸島とデンマークとの物理的距離があり、人の出入りが比較的少ない(コホート集団の追跡が容易)、③鯨を食べない人とともに鯨摂食による高濃度メチル水銀曝露者が存在する(メチル水銀曝露の範囲が広範)、④島民が共通の言語を使用している(言語依存性の検査が実施可能)等による。
フェロー出生コホート研究が先駆的であった点は、水銀曝露指標として出生時の臍帯血濃度と母親の毛髪水銀濃度の両者を測定していたことである。1986~1987年の21ヵ月間に登録された出生コホートの臍帯血水銀濃度の中央値は24.2(0.5~351)μg/l であり、母親の毛髪水銀濃度の中央値は4.5(0.2~39.1)μg/g であった(IPCS の基準値10 μg/g 以上が130名)。このうち250例(24.5%)は臍帯血中の水銀濃度が40 μg/l を超えており、また20 例が100 μg/l 以上であった2)。これら水銀濃度は高い相関を示し、かつ臍帯血セレン濃度とも有意な正の相関があった。また、水銀濃度と有意な関連を示す交絡因子は妊娠中の飲酒歴、母親の知能、フェロー人母親か否か等々であった。さらに、水銀濃度は、月当たりの鯨肉の摂食回数あるいは週当たりの魚(鱈)摂食回数が多くなるにつれ、有意に高くなることが認められた。なお「臍の緒」を用いた分析結果より、フェロー諸島住民の水銀曝露レベルは水俣病患者の1/6~1/5程度と推定されたが9,10)、この母親集団に水俣病あるいはそれに類似する症状を示す人はいなかった3)。
D.7歳児コホートの神経発達検査
メチル水銀の神経発達検査は、上述の母親から生まれた子供たちが7歳に達した1993年および1994年の4~6月にフェロー諸島で行われた3)。用いられた検査は、①メチル水銀曝露に敏感であり、②メチル水銀による障害部位を反映し、③概して特異度が高く、かつ④年齢や文化に適したものが選択された。加えて、コンピュータ支援検査を可能な限り用いるとともに、十分に熟練した検査者が採用された。選択された神経心理学的検査には、finger tapping、持続型反応時間、手−眼協調運動、触覚型performance検査、Wechsler知能検査、Bender視覚運動検査、Boston naming検査、California言語学習検査が含まれた。
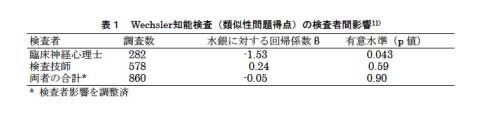
全ての紙と鉛筆を用いる検査はフェロー人臨床神経心理士が行った。しかしながら、ある検査のみ、時間がなくて、特別に訓練された検査技師に代わらざるを得なかった。この検査成績は、臨床神経心理士によって調べられた子供では曝露指標と有意な相関が認められたにもかかわらず、技師によって調べられた子供では有意な相関が見られず、結果としてメチル水銀の量−影響関係が消失した(表1)11)。同様の問題はコンピュータ支援検査でも見られた。このような結果はデータ解釈に当たり、有害影響を過小評価してしまうことになる。より良い正確性を保つためには研鑽を積んだ専門家によって検査が行われる必要がある。
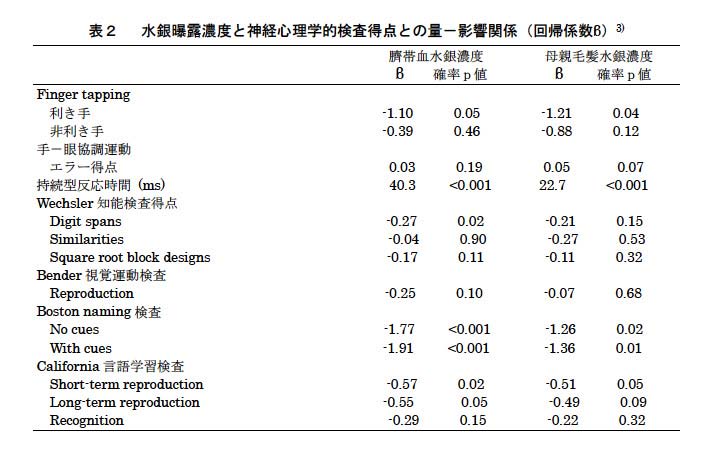
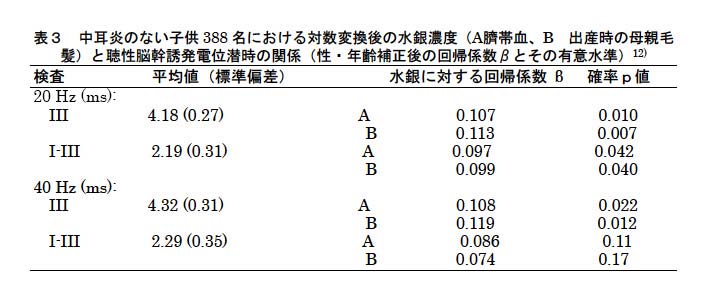
神経心理学的検査の主要な結果を表2に示す。典型的な知能検査ではメチル水銀曝露の影響を見出せなかったが、finger tapping(利き手)、持続型反応時間、Boston naming検査およびCalifornia言語学習検査は出生時の水銀濃度と有意な関係を示した。また、回帰係数は母親の毛髪水銀濃度よりも臍帯血水銀濃度の方が大きな値を示した。この観察は2つの曝露指標が表す妊娠中の曝露時期の違いのせいであろう。さらにフェロー出生コホート研究では、神経学的検査、聴性脳幹誘発電位、視覚誘発電位、身体動揺、心電図RR間隔変動、聴力検査、コントラスト感覚検査、視力検査が行われ、聴性脳幹誘発電位潜時においてはメチル水銀曝露による遅延が示唆された(表3)12) 。
フェロー諸島では鯨の脂身を摂食していることからPCB曝露も考慮する必要がある。すなわち、PCBは必ずしもメチル水銀と同じ標的臓器ないし脳機能に影響を及ぼす訳ではないが、潜在的な交絡因子となりうる。このため、臍帯組織中のPCB濃度も測定された。しかしながら、PCBは神経行動学的機能に有意な影響を及ぼさなかった13)。
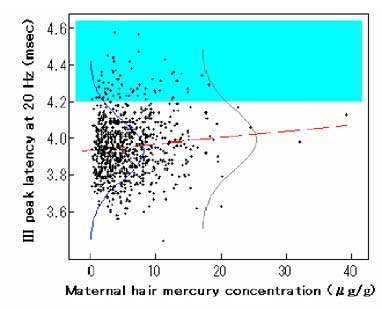
出生時の母親毛髪水銀濃度が神経行動学的および神経生理学的成績に影響し始める臨界濃度はbenchmark dose(BMD)法を用いて検討された14,15)。BMDは、非曝露集団の影響指標における異常確率P0を定め、曝露集団の影響指標がこの異常確率P0に超過確率(これをbenchmark response, BMRと呼ぶ)を加えたP0+BMRになる時の曝露濃度(通常、P0=0.05、BMR=0.05を採用)と定義される(したがって、有意な量−影響関係が成立しないとBMDを算出しても意味がない)16,17)。さらに、BMDの95%信頼下限値BMDLも算出される。このBMDLはno-observed-adverse-effect level(NOAEL、無毒性量)の代用として近年さかんに使用されている18-21)。表4にフェロー出生コホート研究のBMDおよびBMDLを示す14)。また、図3はフェロー諸島の子供たちの聴性脳幹誘発電位のIII波潜時と出生時の母親毛髪水銀濃度を表す15)。ここで算出された10 μg/g のBMDLはニュージーランドの集団で見られた神経行動学的影響指標の結果19)から計算された値とほぼ同様であった。
7歳児のリスク評価(表2)において、臍帯血水銀濃度の方が毛髪水銀濃度より曝露指標として適切であるかもしれないことを前述した。これを確認するために、臍帯血水銀濃度、出生時母親毛髪水銀濃度、1歳児および7歳児毛髪水銀濃度、7歳児血液水銀濃度と神経行動学的検査成績(7歳児)との関係がフェロー出生コホート研究で検討された22)。臍帯血水銀濃度は言語、注意、記憶に関連する変数と強い関連性を示し、一方Bender視覚運動検査(Recall)は7歳児の水銀指標と強い関連性を示した。これまで、多くのメチル水銀曝露のリスク評価研究に母親の出産時毛髪水銀濃度が用いられてきた。しかしながら、毛髪−血中濃度比率(現行250:1)の変動の幅の広さが叫ばれ16)、また母親の毛髪水銀濃度がパーマ処理により20~25%も低下する可能性もあることから23,24)、メチル水銀の曝露指標として臍帯血水銀濃度の方が推奨される25)。
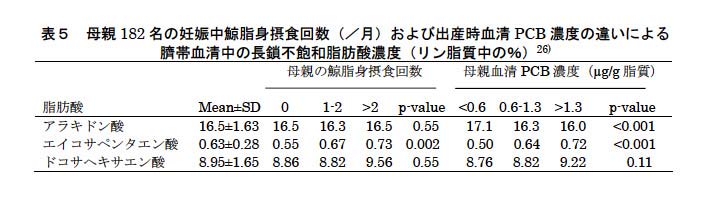
フェロー出生コホート研究で視覚誘発電位潜時が測定されたが、メチル水銀曝露との関連性が見られなかった3)。この理由として、鯨の脂身摂取により長鎖不飽和脂肪酸(エイコサペンタエン酸、ドコサヘキサエン酸など)の摂取量が増え、メチル水銀曝露による視神経障害が抑えられたのではないかと推察された。特に、ドコサヘキサエン酸は胎児や母乳栄養児の知能および視神経発達に必須の成分であると示唆されている。フェロー出生コホートII(1994年出生児)の母子182組で検討すると26)、妊娠中の鯨の脂身摂取回数(および母親の出生時血清PCB濃度)の増加により臍帯血清中エイコサペンタエン酸は有意に増加するが、ドコサヘキサエン酸は増加傾向があるものの有意でなかった(表5)。
セイシェル小児神経発達研究4-6)とフェロー出生コホート研究の比較において、曝露レベルが大体同じであるにもかかわらず、メチル水銀曝露の影響に関する結論が相反している。このため、後者の7歳児結果を論理的補強する論文がGrandjeanらのグループから幾つか発表されている。
①フェロー出生コホート研究では、曝露指標として臍帯血および母親毛髪の2つの水銀濃度、また影響指標として11個の神経行動学的検査が用いられているため、その中の数個に有意な結果が偶然得られても不思議でない。この多重有意性(multiple significance)問題を解決するために共分散構造分析(structural equation model)が使われ、PCBの曝露影響を除外しても、なおメチル水銀曝露による運動機能および言語能力への影響が有意であることを証明した27)。②セイシェルでは低濃度水銀を含む魚介類を頻回摂食し、フェローでは高濃度水銀を含有する鯨肉を時折摂食している。この魚介類摂食パターンの違いが両研究の結論の行方を変えたのではないかとの疑問が一時囁かれた。これに対し、出産時の母親毛髪で頭皮側から2cmまでの水銀濃度と全長毛髪水銀濃度を測定し、これらが著しく異なる母親から生まれた7歳児(胎児期曝露に著しい変動のあった子供)を除いて量−影響関係を再解析しても、表2の結果に影響はなかった28)。③Budtz-Jørgensenらは、曝露と影響指標の関係を検討する際に考慮すべき交絡因子の選択に関して、強い量−影響関係のある影響指標の場合には解析結果に影響を及ぼさない交絡因子(居住地−大きな町に住む住民は小漁村に住む住民に比べ鯨肉摂取量が少ない)が、量−影響関係の弱い指標(例えば、California言語学習検査)においては(この交絡因子を考慮する・しないによって)解析結果に影響(過小評価)を及ぼすことを数理モデルで証明した29)。すなわち、どの交絡因子を用いるべきか十分に吟味しないで一律に解析すると、誤った結論を導き出す可能性がある。
E.14 歳児コホートの神経発達検査
2000年および2001年の4~6月に出生コホートI(1986~1987年に出生した子供)を対象とした14歳児調査が行われた。神経行動学的検査(Neurobehavioral Examination System 2、NES2)を用いた持続型反応時間(図4)の結果は専門領域の会議で発表され30)、現在論文にまとめられつつある。7歳および14歳の両方の検査を受けた819名の子供が対象で、この平均反応時間は14歳(10分間検査)で492±45 msであり、7歳(4分間検査)の750 msよりも早くなっている。臍帯血水銀濃度と14歳児の反応時間は有意な関係があり(相関係数r=0.09、p=0.01)、7歳の時に得られた関係と同様の結果であった。
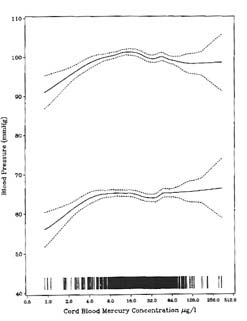
出生コホート7歳児調査でも自律神経機能検査が行われた3)。この時は臍帯血水銀濃度が1~10 μg/l の子供の血圧と有意な量−影響関係を示したが、それ以上の濃度ではその量−影響関係はなくなった(図5)31)。これに対して、14歳児調査では心拍変動CVRRおよびその成分変動(交感および副交感神経機能の活動性を表すLF and HF power、C-CVHF)が臍帯血水銀濃度とのみ有意な負の関係を示した(7歳および14歳の毛髪水銀濃度との有意な量−影響関係はなし) 32)。また、7歳児で有意な量−影響関係が見られた聴性脳幹誘発電位も14歳児に行われた。7歳児で観察されたように、IIIおよびV頂点潜時は臍帯血水銀濃度が高くなるにつれて延長することから、I-III頂点間潜時の延長は出生前のメチル水銀曝露の影響と考えられた33)。一方、III-V頂点間潜時は14歳児毛髪水銀濃度と有意な関連を示し、低濃度ながら現在のメチル水銀曝露の影響と推定された。このように、14歳児まで追跡することによって、胎児期(prenatal)および生後(postnatal)の曝露影響を検証することが可能となった。
2000年4~6月の調査時に14歳児の男子196名のTanner発育分類、睾丸および早朝尿の検査が実施された(図6)。早朝尿では精子の混入(精液尿、spermaturia)の有無が調べられた34)。男子の10.2%(20名)に睾丸発育異常(主に、停留睾丸)があり、このうち3名に精液尿があった。残り176名のうち58名に精液尿があり、精液尿の出現はTannerの発育分類および睾丸サイズと有意な関連があったが、臍帯組織PCB濃度とは関連がなかった。また、血清テストステロン、卵胞刺激ホルモン(FSH)および黄体刺激ホルモン(LH)は精液尿のある男子で高かった。
F.リスク評価からリスク管理へ
フェロー出生コホート研究から得られた結果は、海産物由来のメチル水銀は小児の神経発達に軽度障害を生じさせていることを示した。1989年にフェロー諸島公衆衛生部は、成人は月当たり150~200gのゴンドウ鯨肉を、また100~200gの脂身を超えて食べるべきでないと勧告していた。しかしながら、メチル水銀とともにPCBによる健康影響も考慮して、1998年8月に新たな食事勧告を出した35)。すなわち、鯨肉は水銀含有量が高くかつフェロー諸島住民の主たる水銀曝露源であることから、①鯨肉を月2回以上摂食しない、②3ヶ月以内に妊娠を予定している女性や現在妊娠中あるいは授乳中の女性は鯨肉を食べない、また鯨の脂身には高濃度のPCBが含まれるので、③成人でも脂身の摂食は月に最大2回までに抑える、④潜在的なPCBの有害影響に胎児が晒されないため、女性は出産を終えるまで鯨の脂身を食べない、⑤ゴンドウ鯨の肝および腎臓は全く食べないよう勧告した。この結果、フェロー諸島における毛髪水銀濃度が10 μg/g 以上の母親の割合は1986/1987年に13%、1994年に10%、1998/1999年に3.0%と減少した。まさに、フェロー諸島で行われた研究は単なる調査データから予防医学活動への架け橋となった。
G.メチル水銀の基準摂取量のゆくえ
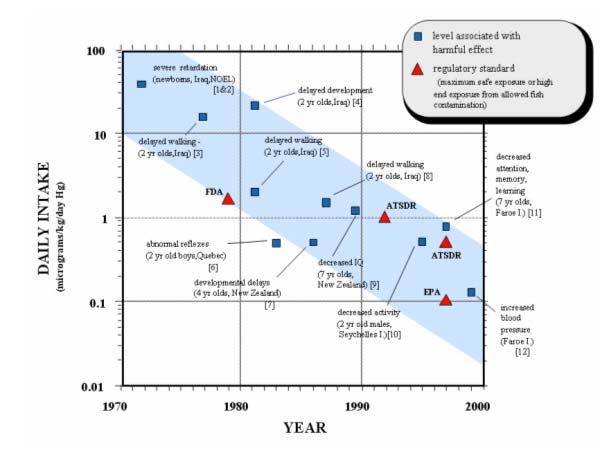
米国EPA36)がイラクのメチル水銀禍のデータを基に算出したメチル水銀摂取基準量(RfD)は、フェロー出生コホート研究の解析結果37)を用いて修正した現在も、0.1 μg/kg 体重/日のままである38)。しかしながら、ヒトに有害影響の現れるメチル水銀の閾値レベルは、科学論文が発表される毎に、徐々に低下する傾向にある(図7)39)。2003年6月11~19日にローマで開催されたFAO/WHO 合同食品添加物専門家委員会(JECFA)は、それまで3.3 μg/kg 体重/週であった暫定的耐容週間摂取量(provisional tolerable weekly intake、PTWI)を、セイシェルとフェロー諸島の両研究データを用いて再計算し、1.6 μg/kg 体重/週とした40)。このようにメチル水銀曝露による健康影響に関する研究は、曝露指標とともに影響指標の吟味・見直しを経ながら、地道ではあるが着実な進歩を遂げているように思える。
一方で、メチル水銀の基準摂取量の設定は、ヒトにとって同様に有害であると烙印を押されている鉛とは異なる側面を持つ。欧州で2007年に実施しようとしている工業製品中の鉛ハンダの全廃は、消費者が代替金属に対する代価を支払うことによって可能となる。しかし、魚介類由来のメチル水銀曝露のゼロリスク指向は、ヒト乳幼児の神経発達に欠かせない長鎖不飽和脂肪酸の摂取制限等を含み、世界の食料問題全体の見直しを必要とするだろう。
Grandjean 教授が米国FDA(食品医薬品局)の諮問委員会委員長Miller博士に送った私信によると、①BMDLはNOAELの代用というよりもlow-observed-adverse-effect level(LOAEL、最小毒性量)に近い値であり、②共分散構造分析を用いたBMDL 算出法の開発により、フェロー諸島の7歳児コホートの全ての曝露指標、交絡因子、影響指標を使用してBMDLを算出すると、毛髪水銀濃度で6μg/g となる。③毛髪−血中濃度比率として250:1が通常使用されるが、個人間差が大きく、フェロー諸島の7歳児コホートから算出すると370となる(大人では250近傍になる)。この変動および個人間の薬力学や薬物動力学の違いを考慮すると、不確実係数(uncertainty factor)は9.6になり、したがってRfDは0.05 μg/kg体重/日と算出されると述べている。しかしながら、この数値が世界規準になると、日本国民の大半はその値を超えてしまい24)、基準値の体をなさない(予防原則でいうproportionalityの欠如)。すなわち、日本の食文化や今後の世界の食糧事情(地球温暖化による牧草地の減少、牛海綿状脳症とクロイツフェルト・ヤコブ病の関係など)を深慮すると、リスク便益原則に合わない可能性が高くなる。
4. おわりに
これまで高濃度メチル水銀曝露による神経障害は非可逆的と考えられてきた41)。しかしながら、フェロー出生コホート14歳児の解析結果より、胎児期低濃度曝露の神経影響は全てではないにせよ可逆的である可能性が示唆された。このような息の長い研究成果を得るためには、フェロー諸島やセイシェルのように人の移動(出入り)が小さい地域住民(国民)の協力がなければ実行不可能である。加えて、研究体制を維持しかつそれら対象集団を追跡するため、国や国際機関からの継続的資金支援の獲得にGrandjean教授が東奔西走していたことも忘れてはならないだろう。
フェロー諸島は胎児期メチル水銀・PCB曝露による小児健康影響に関する情報発信基地となっている。しかしながら、フェロー諸島に4つのコホートが存在していることはあまり知られていない。コホートIは1986/1987年に出産した母子1023組(7歳児調査前に1人死亡しため、論文では1022組)であり、コホートIIは1994年に出産した母子182組である。今回概説した内容は、主にコホートIの解析結果2,3,8,9,11-15,22,25, 27-35,37,42,43)であり、一部がコホートIIのもの26,44)であった。このほかに、1998/1999年出生の650組からなるコホートIIIと、2000/2001年の母親150名からなるコホートIVがあり、2004年にはコホートIIの10歳児調査とコホートIIIの5歳児神経内科学検査が行われる予定になっている。かかる意味で、今後もフェロー出生コホート研究の続報に注目したい。
引用文献
- Kaiser, J. (2000) Mercury report backs strict rules. Science, 289, 371-372. http://www.ncbi.nlm.nih.gov/pubmed/10939938
- Grandjean, P., Weihe, P., Jørgensen, P.J., Clarkson, T., Cernichiari, E. and Viderø, T. (1992) Impact of maternal seafood diet on fetal exposure to mercury, selenium, and lead. Arch. Environ. Health, 47, 185-195. http://www.ncbi.nlm.nih.gov/pubmed/1596101
- Grandjean, P., Weihe, P., White, R.F., Debes, F., Araki, S., Yokoyama, K., Murata, K., Sørensen, N., Dahl, R. and Jørgensen, P.J. (1997) Cognitive deficit in 7-year-old children with prenatal exposure to methylmercury. Neurotoxicol. Teratol., 19, 417-428. http://www.ncbi.nlm.nih.gov/pubmed/9392777
- Shamlaye, C., Marsh, D.O., Myers, G.J., Cox, C., Davidson, P.W., Choisy, O., Cernichiari, E., Choi, A. and Clarkson, T.W. (1995) The Seychelles Child Development Study on neurodevelopmental outcomes in children following in utero exposure to methylmercury from a maternal fish diet: background and demographics. Neurotoxicology, 16, 597-612 http://www.ncbi.nlm.nih.gov/pubmed/8714866
- Davidson, P.W., Myers, G.J., Cox, C., Axtell, C., Shamlaye, C., Sloane-Reeves, J., Cernichiari, E., Needham, L., Choi, A., Wang, Y., Berlin, M. and Clarkson, T.W. (1998) Effects of prenatal and postnatal methylmercury exposure from fish consumption on neurodevelopment: outcomes at 66 months of age in the Seychelles Child Development Study. J. Am. Med. Assoc., 280, 701-707 http://www.ncbi.nlm.nih.gov/pubmed/9728641
- Myers, G.J., Davidson, P.W., Cox, C., Shamlaye, C.F., Palumbo, D., Cernichiari, E., Sloane-Reeves, J., Wilding, G.E., Kost, J., Huang, L.S. and Clarkson, T.W. (2003) Prenatal methylmercury exposure from ocean fish consumption in the Seychelles Child Development Study. Lancet, 361, 1686-1692. http://www.ncbi.nlm.nih.gov/pubmed/12767734
- Faroe Islands Tourist Board (2003) Faroe Islands Tourist Guide 2003. http://www.faroeislands.com/UK/Islands.html.
- Weihe, P. and Grandjean, P. (1994) Sources and magnitude of mercury exposure in the Faore Islands: overall design of the cohort study. In Proceedings of the International Symposium on Assessment of Environmental Pollution and Health Effects from Methylmercury. National Institute for Minamata Disease, 112-126.
- Dalgård, C., Grandjean, P., Jørgensen, P.J. and Weihe, P. (1994) Mercury in the umbilical cord: implications for risk assessment for Minamata disease. Environ. Health Perspect., 102, 548-550. http://www.ncbi.nlm.nih.gov/pubmed/9679113
- Akagi, H., Grandjean, P., Takizawa, Y. and Weihe, P. (1998) Methylmercury dose estimation from umbilical cord concentrations in patients with Minamata disease. Environ Res., 77, 98-103. http://www.ncbi.nlm.nih.gov/pubmed/9600802
- Grandjean, P., White, R.F. and Weihe, P. (2001) Evidence of developmental methylmercury toxicity. In Abstract of 6th International Conference on Mercury as a Global Pollutant. National Institute for Minamata Disease, 233.
- Murata, K., Weihe, P., Araki, S., Budtz- Jørgensen, E. and Grandjean, P. (1999) Evoked potentials in Faroese children prenatally exposed to methylmercury. Neurotoxicol. Teratol., 21, 471-472 http://www.ncbi.nlm.nih.gov/pubmed/10440491
- Grandjean, P., Weihe, P., Burse, V.W., Needham, L.L., Storr-Hansen, E., Heinzow, B., Debes, F., Murata, K., Simonsen, H., Ellefsen, P., Budtz-Jørgensen, E., Keiding, N. and White, R.F. (2001) Neurobehavioral deficits associated with PCB in 7-year-old children prenatally exposed to seafood neurotoxicants. Neurotoxicol. Teratol., 23, 305-317. http://www.ncbi.nlm.nih.gov/pubmed/11485834
- Budtz-Jørgensen, E., Keiding, N. and Grandjean, P. (2001) Benchmark dose calculation from epidemiological data. Biometrics, 57, 698-706. http://www.ncbi.nlm.nih.gov/pubmed/11550917
- Murata, K., Budtz-Jørgensen, E. and Grandjean, P. (2002) Benchmark dose calculations for methylmercury-associated delays on evoked potential latencies in two cohorts of children. Risk Anal., 22, 465-474. http://www.ncbi.nlm.nih.gov/pubmed/12088226
- National Research Council (2000) Toxicological Effects of Methylmercury. National Academy Press.
- Crump, K. (2002) Critical issues in benchmark calculations from continuous data. Crit. Rev. Toxicol., 32, 133-153. http://www.ncbi.nlm.nih.gov/pubmed/12071571
- Crump, K.S., Viren, J., Silvers, A., Clewell, H. III, Gearhart, J. and Shipp, A. (1995) Reanalysis of dose-response data from the Iraqi methylmercury poisoning episode. Risk Anal., 15, 523-532. http://www.ncbi.nlm.nih.gov/pubmed/7480952
- Crump, K.S., Kjellström, T., Shipp, A.M., Silvers, A. and Stewart, A. (1998) Influence of prenatal mercury exposure upon scholastic and psychological test performance: benchmark analysis of a New Zealand Cohort. Risk Anal., 18, 701-713. http://www.ncbi.nlm.nih.gov/pubmed/9972579
- Crump, K.S., Van Landingham, C., Shamlaye, C., Cox, C., Davidson, P.W., Myers, G.J. and Clarkson, T.W. (2000) Benchmark concentrations for methyl- mercury obtained from the Seychelles Child Development Study. Environ. Health Perspect., 108, 257-263. http://www.ncbi.nlm.nih.gov/pubmed/10706533
- Murata, K., Sakai, T., Morita, Y., Iwata, T. and Dakeishi, M. (2003) Critical dose of lead affecting δ-aminolevulinic acid levels. J. Occup. Health, 45, 209-214. http://www.ncbi.nlm.nih.gov/pubmed/14646278
- Grandjean, P., Budtz-Jorgensen, E., White, R.F., Jørgensen, P.J., Weihe, P., Debes, F. And Keiding, N. (1999) Methylmercury exposure biomarkers as indicators of neurotoxicity in children aged 7 years. Am. J. Epidemiol., 149, 301-305. http://www.ncbi.nlm.nih.gov/pubmed/10430235
- Yasutake, A., Matsumoto, M., Yamaguchi, M. and Hachiya, N. (2003) Current hair mercury levels in Japanese: survey in five districts. Tohoku J. Exp. Med., 109, 161-169. http://www.ncbi.nlm.nih.gov/pubmed/12703660
- Iwasaki, Y., Sakamoto, M., Nakai, K., Oka, T., Dakeishi, M., Iwata, T., Satoh, H. and Murata, K. (2003) Estimation of daily mercury intake from seafood in Japanese women: Akita cross-sectional study. Tohoku J. Exp. Med., 200, 67-73. http://www.ncbi.nlm.nih.gov/pubmed/12962403
- Grandjean, P., Jørgensen, P.J. and Weihe, P. (2002) Validity of mercury exposure biomarkers. In Biomarkers of Environmentally Associated Disease, edited by Wilson, S.H. and Suk, W.A. CRC Press/Lewis Publishers, 235-247.
- Grandjean, P., Bjerve, K.S., Weihe, P. and Steuerwald, U. (2001) Birthweight in a fishing community: significance of essential fatty acids and marine food contaminants. Int. J. Epidemiol., 30, 1272-1278. http://www.ncbi.nlm.nih.gov/pubmed/11821327
- Budtz-Jørgensen, E., Keiding, N., Grandjean, P. and Weihe, P. (2002) Estimation of health effects of prenatal methylmercury exposure using structural equation models. Environ. Health, 1, 2. http://www.ncbi.nlm.nih.gov/pubmed/12513702
- Grandjean, P., White, R.F., Weihe, P. and Jørgensen, P.J. (2003) Neurotoxic risk caused by stable and variable exposure to methylmercury from seafood. Ambul. Pediatr., 3, 18-23. http://www.ncbi.nlm.nih.gov/pubmed/12540249
- Budtz-Jørgensen, E., Keiding, N., Grandjean, P., Weihe, P. and White, R.F. (2003) Consequences of exposure measurement error for confounder identification in environmental epidemiology. Stat. Med., 22, 3089-3100. http://www.ncbi.nlm.nih.gov/pubmed/12973789
- Grandjean, P., White, R.F., Debes, F., Weihe, P. and Letz, R. (2002) NES2 continuous performance test results obtained by methylmercury-exposed children at ages 7 and 14 years. In Abstract Book on Neurobehavioral Methods and Effects in Occupational and Environmental Health. Institute of Occupational Health and Industrial Hygiene, University of Brescia, 136.
- Sørensen, N., Murata, K., Budtz-Jørgensen, E., Weihe, P. and Grandjean, P. (1999) Prenatal methylmercury exposure as a cardiovascular risk factor at seven years of age. Epidemiology, 10, 370-375. http://www.ncbi.nlm.nih.gov/pubmed/10401870
- Grandjean, P., Murata, K., Budtz- Jørgensen, E. and Weihe, P. (2004) Cardiac autonomic activity in methylmercury neurotoxicity: 14-year follow-up of a Faroese birth cohort. J. Pediatr., 144,169-76. http://www.ncbi.nlm.nih.gov/pubmed/14760255
- "Murata, K., Weihe, P., Budtz-Jørgensen, E., Jørgensen, P.J. and Grandjean, P. (2004) Delayed brainstem auditory evoked potential latencies in 14-year-old children exposed to methylmercury. J. Pediatr., 144,177-83." http://www.ncbi.nlm.nih.gov/pubmed/14760257
- Mol, N.M., Sørensen, N., Weihe, P., Andersson, A-M., Jørgensen, N., Skakkebæk, N.E., Keiding, N. and Grandjean, P. (2002) Spermaturia and serum hormone concentrations at puberty age in boys prenatally exposed to polychlorinated biphenyls. Eur. J. Endocrinol., 146, 357-363. http://www.ncbi.nlm.nih.gov/pubmed/11888842
- Weihe, P. and Grandjean, P. (2001) Intervention study on methylmercury in the Faroe Islands. In Abstract of 6th International Conference on Mercury as a Global Pollutant, National Institute for Minamata Disease, 234.
- US Environmental Protection Agency. (1997) Mercury Study for Congress. Volume V: Health Effects of Mercury and Mercury Compounds. EPA-452/R-97-007. EPA.
- Budtz-Jørgensen, E., Grandjean, P., Keiding, N., White, R.F. and Weihe, P. (2000) Benchmark dose calculations of methylmercury-associated neurobehavioral deficits. Toxicol. Lett., 112-113, 193-199. http://www.ncbi.nlm.nih.gov/pubmed/10720731
- US Environmental Protection Agency. (2001) Methylmercury (MeHg) (CASRN 22967-92-6). http://www.epa.gov/iris/subst/0073.htm http://www.epa.gov/iris/subst/0073.htm
- Schettler, T., Stein, J., Reich, F. and Valenti, M. (2000) In Harm’s Way: Toxic Threats to Child Development. Greater Boston Physicians for Social Responsibility, http://www.igc.org/psr http://www.ncbi.nlm.nih.gov/pubmed/1187526
- Joint FAO/WHO Expert Committee on Food Additives. (2003) Summary and Conclusions. ftp://ftp.fao.org/es/esn/jecfa/jecfa61sc.pdf. ftp://ftp.fao.org/es/esn/jecfa/jecfa61sc.pdf
- Igata, A. (1993) Epidemiology and clinical features of Minamata disease. Environ. Res., 63, 157-169. http://www.ncbi.nlm.nih.gov/pubmed/8404770
- Dahl, R., White, R.F., Weihe, P., Sørensen, N., Letz, R., Hudnell, K., Otto, D.A. and Grandjean, P. (1996) Feasibility and validity of three computer-assisted neurobehavioral tests in 7-year-old children. Neurotoxicol. Teratol., 18, 413-419. http://www.ncbi.nlm.nih.gov/pubmed/8866532
- Grandjean, P., White, R.F., Sullivan, K., Debes, F., Murata, K., Otto, D.A. and Weihe, P. (2001) Impact of contrast sensitivity performance on visually- presented neurobehavioral tests in mercury-exposed children. Neurotoxicol. Teratol., 23, 141-146 http://www.ncbi.nlm.nih.gov/pubmed/11348831
- Steuerwald, U., Weihe, P., Jørgensen, P.J., Bjerve, K., Brock, J., Heinzow, B., Budtz-Jørgensen, E. and Grandjean, P. (2000) Maternal seafood diet, methylmercury exposure, and neonatal neurological function. J. Pediatr., 136, 599-605. http://www.ncbi.nlm.nih.gov/pubmed/10802490





Ⅲ-3 セイシェル共和国における水銀と健康の問題
1. はじめに
母親の食事由来の低濃度メチル水銀の胎児期曝露が、その後の児の発達に与える影響を検証する疫学的調査として良く知られているのは、デンマーク領Faroe諸島前向き研究(Faroe Islands Prospective Study)とセイシェル小児発達研究(Seychelles Child Development Study: SCDS)の2つである。「Faroe諸島」の疫学的研究では7 歳児において、いくつかの神経心理学的検査にて胎児期のメチル水銀曝露の影響と考えられる得点の低下が認められた。しかしながら、SCDSは対象集団の規模とメチル水銀の曝露量、および神経発達の検査法が「Faroe諸島」の疫学的研究と比較的類似しているにも関わらず、結果的には認知行動への影響は見出されなかった。この理由としては曝露源の違いなどが考えられている1,2)。米国環境保護庁(EPA)のメチル水銀の摂取基準量算出の再評価にはSCDSの結果は考慮されていない。本稿では調査の背景となったセイシェル共和国の自然と人々、生活様式、を紹介するとともにこれまでの調査の主要な結果をまとめ、SCDSの位置づけなどを考えてみた。
2. セイシェル共和国の概要
セイシェル共和国は西インド洋沖、マダガスカル島の西北に位置する大小115の島々よりなる美しい国である(図1)。島の組成は花崗岩および珊瑚島で、島々の面積は合わせて443km2と淡路島ほどの大きさである。人口は約8万人で、そのおよそ8割が、首都ビクトリア(図2)が位置するセイシェルで最も大きな島であるMahe島に居住している。気候は温暖で、青い海と空に浮かぶ島々はまさに「常夏の島々」と呼ぶにふさわしく、その自然の美しさ、また住みやすさから、かねてよりヨーロッパや米国各地から長期休暇を楽しむ観光客に親しまれ、映画の舞台や雑誌のロケなどに利用されてきた。歴史的にはフランス、イギリスの支配を経て、1976年に民主主義国家として独立。翌年にはフランス系の共産主義政党の政権下におかれたが、1991年に再び複数政党の連立政権となって現在にいたっている。住民は、アフリカ系およびフランス系の移住民が主であるが、19世紀に入り、中国、インド系の商人たちが移住し、その人種的背景は複雑である。公用語は英語、仏語、クレオール語(現地語と仏語が混合したもの)の3言語で、宗教は90%がローマンカソリック、8%が英国国教会である。
3. セイシェル共和国における漁業
セイシェル共和国は産業の殆どを観光に頼っているが、遠洋漁業(マグロ漁)の拠点としても有名であり、かつては日本の漁船も多く寄港していた(図3)。セイシェル共和国沿岸で捕獲される魚介類はエビ・カニ類、サバ、数種のタイ類、マグロ類、ハタなど100種類を越えるといわれているが(図4)、最も有名なのはマグロ類で、1日の水揚げ量は実に100 tonにものぼるという。しかしながら住民がマグロを食することはそれほど多くはなく、水揚げされたマグロの殆どは缶詰にされて、ヨーロッパ全土、あるいは旧ソ連、タイなどに輸出されている。また海外の漁船による捕獲も多く、捕獲国は多い順にスペイン、フランス、日本、台湾、韓国となっている3)。住民が最も良く食すのはJack Fishと呼ばれる近海の魚(アジ科)で、その他市場に置かれている魚の種類を見ても漁食が盛んなことがうかがえる。
4. Seychelles Child Development Study(SCDS)の背景
この島国に米国New York州Rochester大学の研究グループが最初に足を運び入れたのは1980年はじめのことである。およそ半世紀に渡り、水銀毒性を研究し続けてきた彼らは、1970年代のイラクのメチル水銀中毒禍の人体の健康影響を調査してきたが、胎児期曝露においては低用量でもメチル水銀毒性が発揮され得ること、その様な曝露は日常的な魚食でおこることから、魚食を主とする調査対象を世界各地で探していた。そこで候補となったのがセイシェルである4)。
調査地としてセイシェルが選択されたのにはいくつかの理由がある。まず第一に、住民のおよそ80%が毎日魚を食するという高い魚摂取量があげられる。島国で人口移動が少ないこと、また、教育水準も高く、英語、仏語がほぼ全域で通じ言葉の壁が無いことも調査をスムーズに推移させるには重要であった。また、2001年度の統計では妊産婦死亡率も乳幼児死亡率も日本より低い値となっており、(この国で問題とされる健康問題は肥満、脳血管疾患、心臓病などの生活習慣病)、医療水準に不安がないことも重要であった。共産主義の名残で、貧富の差が少ない (医師と事務官の給料の差は1.5倍) ことは児の発達に対する家庭環境等の影響を調整する上で好ましい。農薬など、他の化学物質の曝露も低いと言われている。何よりも当時、児の発達支援に力を入れていたセイシェル政府の力添えは大きかった。検査は全てRochester大学にて特別なトレーニングを受けた、現地の小児医療スタッフが行い、Rochester大学スタッフによる定期的な査察と検証が行われた4,5)。
5. 予備調査
SCDSは大きく予備調査と本調査の2つに分けられる。
予備調査として位置づけられるのは 1987年の一年間と1989年の一年間にMahe島で産まれた804組の母子を対象として、出生後5~109週(789人)、および66ヶ月(前後3ヶ月の期間内、247人)で行われた2つの調査である。胎児期の水銀曝露指標としては母親の毛髪で、妊娠中に生えてきたと思われる部分(毛髪が1ヶ月に1.1cmのびるとし、出産時に得られた毛髪では地肌から9cmの部分が妊娠の初期8ヶ月間にのびたと推定)6)の総水銀濃度が用いられ、平均は6.6ppmであった。交絡因子に関する情報は母親のインタビューによって得られた7)。
児の発達の指標は出生後5~109週では改訂版デンバー式発達スクリーニングテスト(DDST-R:Revised Denver Developmental Screening Test)が用いられ、児の性、生下時体重、APGARスコア、検査時年齢、母親の年齢、妊娠中のアルコール摂取と喫煙、医療歴、社会経済因子(部屋あたりの家族数)を共変量として、ロジスティック回帰分析が行われた。結果的には異常と判定された群と異常が疑わしい群をあわせた場合、水銀との関連が有意であった。8)
66ヶ月時にはMcCarcy Scales of Children’s Abilities、Preschool Language Scale(PLS)が測定され、重回帰分析の結果、McCarcyの全般的認知指数(GCI:General Cognitive Index)が毛髪総水銀の最低と最高の群で共変量の補正後も有意差があり、知覚に関するサブスケール、PLSの聞き取りの項目でも有意な水銀の影響が認められた。9)
しかしながら、著者らはこの結果からは水銀の影響がはっきりしたとは言えないと主張した。 はずれ値の検討をするといくつかの関係は失われ、66ヶ月時では対象者数が少なすぎた。また発 達検査の方法も児の月齢に幅がありすぎて妥当ではないと判断された。共変量も不十分であると された。そこで本調査では調査の時期をそろえ、対象者数を確保した調査が6.5、19、29、およ び109ヶ月時で行われた10)。
6. 本調査(6.5ヶ月)
6.5ヶ月の本調査は740名で行われた。児の検査としてはFagan Test of Intelligence(FTII:児の視覚認知能力を測定する)とDDST-Rが行われた。詳細は割愛するが、共変量として主たる育児者の知能、両親の教育歴、母乳保育歴、家庭で使用される言語、家庭の収入が追加された。統計解析には重回帰分析とロジスティック回帰分析が行われた。DDST-Rでは異常群が3名、異常が疑わしい群が11名と数が少なく、分析不能と判断された。またFTIIでも水銀の影響は有意ではなかった10,11)。
7. 本調査(19・29ヶ月)
生後 19ヶ月(738人)と29ヶ月(736人)の追跡調査では、新たにベイリー式乳幼児発達検査(BSID:Bayley Scale of Infant Development、心理発達指標と運動発達指標の2指標を算出する)、および29ヶ月ではその行動記録であるBehavior Recordが用いられた。また19ヶ月のインタビューでは主たる保育者の知能テストであるレーブン視覚マトリックス検査(Raven standard progressive matrices tests)、家庭環境評価(Home Observation for Measurement of the Environment: HOME)が行われた。重回帰分析の結果、水銀の影響が有意であったのは、29 ヶ月のBSID のBehavior RecordのActivityの男児の結果のみで、それも性や家庭環境が大きな影響を持っていた。10,12)
8. 本調査(66ヶ月)
66カ月の本調査は、711人で行われた。行われた児のテストバッテリーは①McCarthy のGCI、②PLS、③Woodcock-Johnson (W-J) Tests of AchievementのLetter-Word Recognition、④W-J Tests of AchievementのApplied Problems 、⑤ベンダー視覚運動検査(Bender Gestalt test)、⑥乳児の行動チェックリスト(Child Behavior Checklist:CBCL)の6つであった。曝露指標は妊娠中の母親の毛髪総水銀濃度、対象児の毛髪総水銀濃度、および49名の対象児については血中PCB濃度が測定された。共変量は前回のstudyと大差ないが、社会経済状況を表す指標として、Hollingsheadの社会経済状況が用いられた13)。
結果は、6つのテストのいずれにおいても、出生前、出生後の水銀曝露の指標と関連して成績の低下が見られるものはなく、むしろ出生後の水銀曝露が最高値の群で、よい結果を示しているものもあった。重回帰分析の結果もこの関係性は保たれていた14)。
9. 本調査(9歳)
9歳児の調査は779人で行われた。曝露指標は母親の妊娠中の毛髪総水銀値、及び出産後の毛髪総水銀値で、児の神経心理学的検査にはWechsler知能検査Ⅲ(WISCⅢ)、W-J Tests of AchievementのLetter-Word Recognition、W-J Tests of AchievementのApplied Problems、California 言語学習検査、Bostonネーミング検査、フィンガータッピング、手—目協調運動、ペグボード差し、なぞり書き試験、wide range assessment of memory and learning (WARMAL)、持続型反応時間、CBCL、Connor’s teacher rating scale(CTRS)など、13の検査、21のエンドポイントが用いられた。これだけの試験のうち、水銀曝露と有意な相関があったものは男児での非利き手でのペグボード差し(時間:秒)とCTRSの多動指数の2つのみで、共変量を考慮して重回帰分析を行うとこれらの関係は弱められ、著者らは偶然による要素が大きいと判断した15)。
10. SCDSの位置付けと今後の展望
SCDSではいずれの年齢の調査においても、Faroe諸島で認められたレベルの胎児期メチル水銀曝露に関連する心理・発達試験の得点の低下は認められなかった。この結果を踏まえてのことか、魚由来の水銀の問題が社会問題となりつつ現状においても、少なくともセイシェル国内ではそれほどセンセーショナルな問題としては取り上げられていないようだ。政府は研究に協力的であり、むしろ栄養学や小児保健の立場から、米国の技術が入ることは好ましいと考えているようだった。しかしながら、これだけ水産業の盛んな国において魚の安全性の議論は無視出来ないだろう。セイシェルでの調査で独特であるのは、人種差をどのように考慮するのかということだ。言語背景が各家庭でことなることも重要であろう。オリーブ油やココナツ油を多く採る食生活は近年控えられているようであるが、それがどのような修飾要因となるのだろうか。またJack Fish由来の水銀や汚染化学物質のパターンがFaroe諸島における曝露源である鯨のそれと違うことは、かねてより議論の対象である1,2)。国土に畑が少ない状況では、野菜などは一部を除いては輸入されていることがうかがえるが、その様な食物の農薬などの化学物質の曝露は管理されているのかも疑問が残る。
栄養学的背景に重きを置いた Rochester大学グループは、アイルランドの栄養研究グループと共同で、母親及び児の摂取栄養素に注目した第二次疫学調査を2001年より開始した。調査では妊娠28週、出産時、1、5,9,15,24ヶ月時の母子の栄養学的調査(思い出し法による献立調査)と5、9、15,24ヶ月児のBSID、FTII、Visual Expectation test(VexP:視覚的予期能力測定法、図5)が行われる予定である。2002年夏までに300名の登録が終了し、追跡調査が施行されている段階である。セイシェル国内における食生活の変化(若い世代では漁食の回数が減り、肉中心の食生活に変化してきていると言う)、環境全般の変化に伴い、どのような影響が認められるのか、今後の結果を見守りたい。
引用文献
- Mahaffey, K.R. (1998) Methylmercury exposure and neurotoxicity [comment]. JAMA, 280, 737-8. http://www.ncbi.nlm.nih.gov/pubmed/9728648
- Nakai, K, Satoh, H. (2002) Developmental neurotoxicity following prenatal exposures to methylmercury and PCBs in humans from epidemiological studies. Tohoku J Exp Med, 196, 89-98. http://www.ncbi.nlm.nih.gov/pubmed/12498320
- Annual Report (2001) Seychelles Fishing Authority
- Marsh, D.O., Clarkson, T.W., Myers, G.J., Davidson, P.W., Cox, C., Cernichiari, E., Tanner, M.A., Lednar, W., Shamlaye, C.F., Choisy, C.H., Merlin, M. (1995) The Seychelles study of fetal methylmercury exposure and child development: Introduction. Neurotoxicology, 16, 583-586. http://www.ncbi.nlm.nih.gov/pubmed/8714865
- Shamlaye, C.F., Marsh, D.O., Myers, G.J., Cox, C., Davidson, P.W., Choisy, O., Cernichiari, E., Choi, A., Tanner, M.A., Clarkson, T.W. (1995). The Seychelles Child Development Study on neurodevelopmental outcomes in children following in utero exposure to methylmercury from a maternal fish diet: Background and demographics. Neurotoxicology, 16, 597-612. http://www.ncbi.nlm.nih.gov/pubmed/8714866
- Cox, C., Clarkson, T.W., Marsh, D.O., Amin-Zaki, L., Tikriti, S., Myers, G.G. (1989) Dose-response analysis of infants prenatally exposed to methyl mercury: an application of a single compartment model to single-strand hair analysis. Environ Res; 49(2):318-32. http://www.ncbi.nlm.nih.gov/pubmed/2473897
- "Myers, G.J., Marsh, D.O., Cox, C., Davidson, P.W., Shamlaye, C.F., Tanner, M.A., Choi, A., Cernichiari, E., Choisy, O., Clarkson, T.W. (1995) A pilot neurodevelopmental study of Seychellois children following in utero exposure to methylmercury from a maternal fish diet. Neurotoxicology, 16, 629-38." http://www.ncbi.nlm.nih.gov/pubmed/8714868
- Myers, G.J., Davidson, P.W., Cox, C., Shamlaye, C.F., Tanner, M.A., Choisy, O., Sloane-Reeves J, Marsh DO, Cernichiari E, Choi A, Berlin M, and Clarkson TW. (1995) Neurodevelopmental outcomes of Seychellois children sixty six months after in utero exposure to methylmercury from a maternal fish diet: pilot study. Neurotoxicology, 16, 639-652 http://www.ncbi.nlm.nih.gov/pubmed/8714869
- Myers, G.J., Davidson, P.W., Cox, C., Shamlaye, C.F., Tanner, M.A., Marsh, D.O., Cernichiari, E., Lapham, L.W., Berlin, M., Clarkson, T.W. (1995) Summary of the Seychelles Child Development Study on the relationship of fetal methylmercury exposure to neurodevelopment. Neurotoxicology, 16, 711-716. http://www.ncbi.nlm.nih.gov/pubmed/8714875
- Myers, G.J., Marsh, D.O., Davidson, P.W., Cox, C., Shamlaye, C.F., Tanner, M.A., Choi, A., Cernichiari, E., Choisy, O., Clarkson, T.W. (1995) Main neurodeveopmental study of Seychellois children following in utero exposure to methylmercury from a maternal fish diet: outcome at six months. Neurotoxicology 16, 653-664. http://www.ncbi.nlm.nih.gov/pubmed/8714870
- "佐藤洋、「有機水銀の健康影響関する文献レビユー」重金属の健康影響に関する総合研究班総会、有機水銀の健康影響に関する研究、H9 年度報告書(財)日本公衆衛生協会"
- Davidson, P.W., Myers, G.J., Cox, C., Shamlaye, C., Choisy, O., Sloane-Reeves, J., Cernichiari, E., Marsh, D.O., Berlin, M., Tanner, M.A., Clarkson, T.W. (1995) Longitudinal neurodevelopmental study of Seychellois children following in utero exposure to methylmercury from maternal fish ingestion: outcomes at 19 and 29 months. Neurotoxicology, 16, 677-688 http://www.ncbi.nlm.nih.gov/pubmed/8714872
- Davidson, P.W., Myers, G.J., Cox, C., Axtell, C., Shamlaye, C., Sloane-Reeves, J., Cernichiari, E., Needham, L., Choi, A,. Wang, Y., Berlin, M., Clarkson, T.W. (1998) Effects of prenatal and postnatal methylmercury exposure from fish consumption on neurodevelopment: Outcomes at 66 months of age in the Seychelles child Development Study. JAMA, 280, 701-707. http://www.ncbi.nlm.nih.gov/pubmed/9728641
- 佐藤洋、「有機水銀の健康影響関する文献レビユー」重金属の健康影響に関する総合研究班総会、有機水銀の健康影響に関する研究、H10 年度報告書(財)日本公衆衛生協会
- Myers, G.J., Davidson, P.W., Cox, C., Shamlaye, C.F., Palumbo, D., Cernichiari, E., Sloane-Reeves, J,. Wilding, G.E., Kost, J., Huang, L.S., Clarkson, T.W. (2003) Prenatal methylmercury exposure from ocean fish consumption in the Seychelles child development study. Lancet; 361, 1686-92. http://www.ncbi.nlm.nih.gov/pubmed/12767734





Ⅲ-4 実験動物におけるメチル水銀の健康影響・胎児期曝露影響
1997 年以降に発表された論文を対象に実験動物におけるメチル水銀の健康影響・胎児期曝露影響についてレビューをした。
1.メチル水銀が実験動物に及ぼす健康影響
メチル水銀の急性および亜急性毒性
Shigematsuら1)は塩化メチル水銀(0.7 mg/kg/day)を85日間投与したラットの脳について検討して、local cerebral glucose utilization (LCGU) がメチル水銀投与によって顕著に低下することを見出している。Takenagaら2)は塩化メチル水銀(5 mg/kg/day)を12回投与したラットにneuromuscular transmissionの低下が認められると報告している。Usukiら3)は骨格筋に対するメチル水銀の影響を観察し、塩化メチル水銀(5 mg/kg/day for 12 days)を経口投与したラットに筋力低下を認めるとともに、骨格筋中のメチル水銀濃度が肝臓、腎臓および脳などの組織よりも高いことを報告している。骨格筋中では特にミトコンドリア酵素群の活性低下が認められ、この現象はミトコンドリアが豊富なことが知られているヒラメ筋で顕著であったことから、メチル水銀は骨格筋のミトコンドリア機能を障害するという可能性が考えられる。
Chakrabartiら4)は脳や末梢における生体アミン類の調節に重要な役割を演じるモノアミンオキシダーゼに対するメチル水銀(0, 5, 7.5 mg/kg/day for 7 or 10 days)の影響をラットで観察し、脳中の様々な部位で本酵素の活性抑制が認められ、さらに末梢血中の血小板においても同様の阻害が観察されることを明らかにした。この結果から、彼らは血小板中のモノアミンオキシダーゼ活性がメチル水銀による中枢神経障害のマーカーになるとしている。Shinyashikiら5)はラット脳のnitric oxide synthase活性が塩化メチル水銀(10 mg/kg/day for 8 days)の皮下投与によって上昇することを見出し、これがnNOSの蛋白質レベルの上昇によるものでiNOSの誘導によるものではないことを明らかにしている。
Thompsonらはメチル水銀毒性に対して保護効果を示すと考えられるグルタチオンの組織中濃度に対するメチル水銀の影響を検討し、塩化メチル水銀(3, 10 ppm)を含む飲料水を4週間与えたマウスの脾細胞中でグルタチオンレベルの減少を認めている6)。さらにThompsonら7)は塩化メチル水銀(3, 10 ppm)を含む飲料水を12週間与えてもマウスの脳、肝臓および腎臓中のグルタチオン濃度も測定し、これらの組織中グルタチオン濃度はメチル水銀の影響をほとんど受けなかったが、脳中のグルタチオン合成酵素濃度は未処理マウスに比べて30%上昇していたと報告している。彼らは本論文で、脳中のグルタチオン合成活性がメチル水銀毒性の良い指標になると述べている。
Etoら8)は霊長類であるコモン・マーモセットに塩化メチル水銀(0.5 ppm)を含む水を37日間与えたところ、大脳白質に比較的高濃度のメチル水銀蓄積と共に浮腫が認められたと報告している。さらに、Etoら9)はメチル水銀投与期間を延長するなどして、コモン・マーモセットに対するメチル水銀の影響を観察し、ヒトの大脳および小脳の病理学的変化と類似の病変が生じることを見出している。
メチル水銀の慢性毒性
Yasutakeら10)およびEtoら11)は、ラットにメチル水銀(0, 0.1, 5 ppm)を含む飼料(16 g/rat/day)を週6日ずつ投与し続け、その影響を観察した。その結果、全群のラットとも少なくとも2年間は中枢神経障害や体重減少は観察されなかった。また、2.5年後までに全ての群で後肢交差が認められたが、対照群でも認められたことからこれは加齢によるものと思わる。水銀の蓄積濃度が最も高かったのは腎臓であり、メチル水銀による影響も腎臓のみで顕著であった。腎臓では0.1及び5 ppm群ともに、重金属毒性防御に関わるグルタチオン及びメタロチオネインの濃度が上昇し、抗酸化酵素であるglutathione peroxidaseの活性の低下が観察された。腎機能に関しても、5 ppm群において血漿クレアチニン濃度の上昇が認められ、さらに貧血が観察された10)。また、病理学的な解析により、糸球体では繊維化とIgG, IgM及び C3の沈着が5 ppm群において観察されたが、中枢神経系には顕著な病変は認められなかった11)。
メチル水銀の毒性発現機構に関する研究
メチル水銀がチューブリンの重合による微小管形成を阻害することが知られている12, 13)。Ishidaら14)は、ラットに塩化メチル水銀(10 mg/kg/day)を7日間連続投与して、脳組織におけるチューブリンのカルボキシル末端のチロシン化に対する影響を観察した。その結果、総チューブリン濃度の変動はなかったが、非チロシン化チューブリン量の顕著な減少が観察され、さらに、チューブリンのチロシン化に関わるチューブリン/チロシンリガーゼの活性低下が認められた。この結果は、メチル水銀がチューブリンのチロシン化機構に影響を与えることによって、微小管形成阻害を介した細胞障害を引き起こす可能性を示唆している。
メチル水銀の毒性発現に影響を与える化合物
セレン化合物がメチル水銀の神経毒性を軽減することが知られている15-17)。Farinaら18)は、セレンを含有する抗酸化剤であるebselenのメチル水銀毒性に対する効果を検討し、授乳中のラットにメチル水銀を皮下投与した際に認められる肝臓中での過酸化に対してebselenは軽減効果を示さなかったが、glutathione peroxidase活性の減少を抑制したと報告している。
また、Kimら19)はメチル水銀毒性に対するメラトニンの効果を検討している。彼らの検討によると、塩化メチル水銀(40 mg Hg/g)を飼料に混ぜて5週間連続投与したマウスは35日目に40%が死亡したが、メラトニン(20 mg/ml)を飲料水に入れて同時投与したマウスは100%が生存した。メチル水銀による脳中過酸化レベルの上昇がメラトニン投与群では顕著に軽減されていたことから、彼らはメラトニンの抗酸化作用がメチル水銀毒性を軽減したものと考察している。
Usukiら20)はラットを用いた検討により、メチル水銀によって引き起こされる骨格筋ミトコンドリア中の電子伝達系に関わる酵素群の活性抑制がビタミンE類似物質であるTrolox(6-hydroxy-2,5,7,8-tetramethylchroman-2-carhoxylic acid)の投与によって軽減されることを見出し、酸化ストレスがメチル水銀毒性に関わっていると考察している。
2.メチル水銀の胎児期曝露影響
ストレスの負荷がメチル水銀の胎児毒性に与える影響
Colominaら21)は妊娠マウスへの拘束ストレスとメチル水銀の同時曝露が出生仔の成長や行動に及ぼす影響を観察した。彼らはマウスを妊娠15—18日の間ステンレスホルダー中に固定するとともにその4日間メチル水銀(2 mg/kg/day)を経口投与したが、観察した全ての項目において出生仔に対する影響は認められなかったと報告している。同時に観察した亜ヒ酸と拘束ストレスとの同時曝露によってpinna detachmentおよび開眼の遅延が認められており(亜ヒ酸単独では認められない)、母胎の拘束ストレスが環境汚染物質の胎児影響を増悪させる影響は否定できないが、このような研究では単独で何らかの影響が認められる投与量のメチル水銀を用いる必要があろう。また、Yinら22)は妊娠マウスへの温熱ストレス負荷とメチル水銀投与が出生仔の行動に及ぼす影響を検討している。彼らは妊娠マウスを妊娠12~15日目にかけて37℃または42℃の温水中に10分間浸け(1日1回又は2回)、さらに妊娠12日目にのみ温熱ストレス負荷の2時間後に塩化メチル水銀(5 mg Hg/kg)を投与した。ここで生まれたマウスは、親への温熱ストレス負荷による歩行能力の遅延が性別に関係なく認められたが、その程度はメチル水銀処理群の方が軽度であった。また、open field testによる運動能力検査では特に雌に、親マウスのメチル水銀処理による影響が認められたが、その程度は温熱ストレス負荷群の方が軽度であった。この結果は、妊婦への高温曝露がメチル水銀の胎児影響に何らかの影響を与える可能性を示唆している。
メチル水銀の胎児期曝露が出生児に与える諸影響
Doreら23)は妊娠7~9日または12~14日に塩化メチル水銀(4, 6 mg/kg/day, p.o.)投与して、出生仔が6週又は16週令になった時点で行動影響を観察し、妊娠12~14日にメチル水銀を投与した場合の方が影響が大きいと報告している。Kakitaら24)は雌ラットに塩化メチル水銀(1, 2, 3 mg/kg/day, p.o.)を交配の5または12日前から妊娠後期までの期間連日投与し、妊娠22日目に胎児の脳について組織化学的検査を行ったところ、認められた病変のパターンは授乳ラットまたは成熟ラットにメチル水銀を投与した際に認められるものとは異なっていた。この結果は胎児の脳がメチル水銀によって特異的な障害を受ける可能性を示唆している。Sakamotoら25)は生後1日から30日以上に渡ってラットに連日塩化メチル水銀(5 mg/kg/day)を経口投与して、脳の病理組織学的検討を行った。その結果、様々な病変を認められたが、それらが胎児性水俣病患者の病変によく似ており、出生直後のラットのメチル水銀処理が胎児性水俣病の良いモデルになると述べている。NewlandとRasmussen26)は妊娠中にメチル水銀を投与した母親から生まれたラットの神経症状は生後500日以上経過しても維持されると報告している。
Rossiら27)はラットに妊娠7日から授乳までの期間塩化メチル水銀(0.5 mg/kg/day)を投与して、出生仔(6ヶ月齢)の運動能力および学習能力を観察し、メチル水銀の胎児期曝露による自発運動および自発学習能力の低下が雄にのみ認められたと報告している。これまでにもメチル水銀の毒性発現に性差が認められるとの報告はあるが、メチル水銀の胎児期曝露影響に顕著な性差が認められるという本報告はメチル水銀毒性の性差を考えるうえで興味深い。一方、Gouletら28)はマウスの妊娠期間中及び出生後にかけて飲料水から塩化メチル水銀(4, 6, 8 ppm)を与え、出生仔(6週令または12週令)の行動学的解析を行った。そして、メチル水銀の胎児期および出生後曝露による影響は雌にのみ認められたと報告している。また、Kim ら29)は3種の異なる系統(BALB/c, C57BL/6J, C57BL/6Cr)のマウスの妊娠12~14日目に塩化メチル水銀(3 x 3 mg/kg)を経口投与し、出生した仔について行動学的解析を行い、明らかな系統差が認められると報告している。
Watanabeら30)は必須微量元素であるセレン濃度の異なる飼料(0.02, 0.05, 0.4 ppm; 0.4ppmが正常濃度)で飼育したマウスの妊娠12~14日目に塩化メチル水銀(5, 9 mg Hg/kg)を投与し、出生仔の行動異常等を観察した。その結果、メチル水銀 9 mg/kg, セレン 0.02 ppm群で最も顕著な影響が認められ、また、メチル水銀投与による脳中glutathione peroxidase活性とセレン濃度の著しい減少が観察されたと報告している。ChakrabartiとBai31)は妊娠期間から授乳期までの間ラットに蛋白質濃度の異なる飼料)(3.5%または20%、20%が正常)を与え、生まれた仔にも母親と同じ飼料を与えるとともに出生21目または60日目から塩化メチル水銀(7.5 mg/kg)を10日間連続して投与し後肢交差の発症を観察した。その結果、低蛋白食群の方がメチル水銀の影響を受けやすいというデータが得られたが、低蛋白食によって引き起こされる脳中での蛋白質合成能の低下はメチル水銀による影響を受けなかった。この結果から、蛋白質合成能の低下はメチル水銀に対する感受性を増強させると考えられる。
Zanoliら32)は妊娠15日目のラットに塩化メチル水銀(8 mg/kg/day)を経口投与したところ、出生仔の脳のopioid receptor結合能がメチル水銀曝露群で増加していたことから、胎児期のメチル水銀曝露がopiatergic systemに影響を与えると考察している。Haykal-Coatesら33)はラットに妊娠6~15日の間塩化メチル水銀(0.1, 2 mg/kg/day)を経口投与し、出生仔脳中のprotein kinase C濃度を測定し、2 mg/kgのメチル水銀投与群においてprotein kinase C濃度の減少が認められることを報告している。
Szaszら34)はラットに塩化メチル水銀(0.375 mg/body weight/day)を交配以前から授乳時まで飲料水に含ませて与えて出生させた生後4 日齢ラットについて、3-aminopyridine誘発性のてんかん様症状を観察し、メチル水銀処理ラットから生まれた仔はてんかんが発症しやすいことを報告している。
メチル水銀が胎児に与える影響
Watanabeらはマウスの妊娠12~14日目に連日塩化メチル水銀(5, 9 mg Hg/kg)を皮下投与し妊娠17日目の胎仔脳中のセレン含有酵素活性を測定した。その結果、メチル水銀の投与は母親の脳中glutathione peroxidase活性には影響を与えなかったが、胎仔脳中活性を顕著に阻害した。また、胎仔脳中の5-iodothyronine deiodinases活性は減少し、5'-iodothyronine deiodinases活性は増加した35)。さらにWatanabeらは妊娠マウスのメチル水銀処理が胎仔脳中のグルタチオンレベルを顕著に増加させることも確認している36)。
Thompsonら37)は塩化メチル水銀(3, 10 ppm)を含む飲料水を交配の2週間前から妊娠期間にかけてマウスに与え、妊娠12日と16日の胎仔のグルタチオン濃度を測定した。その結果、母親へのメチル水銀投与によって、総グルタチオン濃度(GSH + GSSG)には変化がなかったが、還元型グルタチオン(GSH)の減少とグルタチオン還元酵素活性の増加が認められたと報告している。
3.考察
1997年以降に発表された論文を対象にレビューをしたが、それぞれの論文が興味深い知見を提供しているものの、完成度の高い論文は比較的少なかった。特にメチル水銀の胎児期曝露影響に関しては、もう少し大規模で組織的な研究が必要のように思われる。
4.結論
メチル水銀の健康影響について、様々な角度からの検討結果が報告されているが、さらなる進展を期待したい。
引用文献
- Shigematsu J, Yasuda T, Goto Y, et al., Chronic effects of methylmercury on the cerebral function in rats, J Neurol Sci 2000; 182: 69-75. http://www.ncbi.nlm.nih.gov/pubmed/11102642
- Takenaga S, Arimura K, Miyamoto K, et al., Depression of neuromuscular transmission in methylmercury-poisoned rats: a glass microelectrode and single fiber electromyography study, Acta Neurol Scand 1997; 96: 40-45. http://www.ncbi.nlm.nih.gov/pubmed/9262131
- Usuki F, Yasutake A, Matsumoto M, et al., The effect of methylmercury on skeletal muscle in the rat: a histopathological study, Toxicol Lett 1998; 94: 227-232. http://www.ncbi.nlm.nih.gov/pubmed/9609326
- Chakrabarti SK, Loua KM, Bai C, et al., Modulation of monoamine oxidase activity in different brain regions and platelets following exposure of rats to methylmercury, Neurotoxicol Teratol 1998; 20: 161-168. http://www.ncbi.nlm.nih.gov/pubmed/9536461
- Shinyashiki M, Kumagai Y, Nakajima H, et al., Differential changes in rat brain nitric oxide synthase in vivo and in vitro by methylmercury, Brain Res 1998; 798: 147-155. http://www.ncbi.nlm.nih.gov/pubmed/9666107
- Thompson SA, Roellich KL, Grossmann A, et al., Alterations in immune parameters associated with low level methylmercury exposure in mice, Immunopharmacol Immunotoxicol 1998; 20: 299-314. http://www.ncbi.nlm.nih.gov/pubmed/9653674
- Thompson SA, White CC, Krejsa CM, et al., Induction of glutamate-cysteine ligase (gamma-glutamylcysteine synthetase) in the brains of adult female mice subchronically exposed to methylmercury, Toxicol Lett 1999; 110: 1-9. http://www.ncbi.nlm.nih.gov/pubmed/10593589
- Eto K, Yasutake A, Kuwana T, et al., Methylmercury poisoning in common marmosets--a study of vulnerability within the cerebral cortex, Toxicol Pathol 2001; 29: 565-573. http://www.ncbi.nlm.nih.gov/pubmed/11695574
- Eto K, Yasutake A, Korogi Y, et al., Methylmercury poisoning in common marmosets--MRI findings nerve lesions, Toxicol Pathol 2002; 30: 723-734. http://www.ncbi.nlm.nih.gov/pubmed/12512874
- Yasutake A, Nakano A, Miyamoto K, et al., Chronic effects of methylmercury in rats. I. Biochemical aspects, Tohoku J Exp Med 1997; 182: 185-196. http://www.ncbi.nlm.nih.gov/pubmed/9362101
- Eto K, Yasutake A, Miyamoto K, et al., Chronic effects of methylmercury in rats. II. Pathological aspects, Tohoku J Exp Med 1997; 182: 197-205. http://www.ncbi.nlm.nih.gov/pubmed/9362102
- Miura K, Imura N, Mechanism of methylmercury cytotoxicity, Crit Rev Toxicol 1987; 18: 161-188. http://www.ncbi.nlm.nih.gov/pubmed/3325226
- Miura K, Inokawa M, Imura N, Effects of methylmercury and some metal ions on microtubule networks in mouse glioma cells and in vitro tubulin polymerization, Toxicol Appl Pharmacol 1984; 73: 218-231. http://www.ncbi.nlm.nih.gov/pubmed/6369629
- Ishida Y, Ichimura T, Sumi H, et al., Methylmercury alters the tyrosination status of tubulin in the brains of acutely intoxicated rats, Toxicology 1997; 122: 171-181. http://www.ncbi.nlm.nih.gov/pubmed/9328217
- Iwata H, Okamoto H, Ohsawa Y, Effect of selenium on methylmercury poisoning, Res Commun Chem Pathol Pharmacol 1973; 5: 673-680. http://www.ncbi.nlm.nih.gov/pubmed/4701263
- Nishikido N, Satoh Y, Naganuma A, et al., Effect of maternal selenium deficiency on the teratogenicity of methylmercury, Toxicol Lett 1988; 40: 153-157. http://www.ncbi.nlm.nih.gov/pubmed/3341056
- Ganther HE, Goudie C, Sunde ML, et al., Selenium: relation to decreased toxicity of methylmercury added to diets containing tuna, Science 1972; 175: 1122-1124. http://www.ncbi.nlm.nih.gov/pubmed/5062150
- Farina M, Soares FA, Zeni G, et al., Additive pro-oxidative effects of methylmercury and ebselen in liver from suckling rat pups, Toxicol Lett 2004; 146: 227-235. http://www.ncbi.nlm.nih.gov/pubmed/14687760
- Kim CY, Nakai K, Kameo S, et al., Protective effect of melatonin on methylmercury-Induced mortality in mice, Tohoku J Exp Med 2000; 191: 241-246. http://www.ncbi.nlm.nih.gov/pubmed/11038016
- Usuki F, Yasutake A, Umehara F, et al., In vivo protection of a water-soluble derivative of vitamin E, Trolox, against methylmercury-intoxication in the rat, Neurosci Lett 2001; 304: 199-203. http://www.ncbi.nlm.nih.gov/pubmed/11343836
- Colomina MT, Albina ML, Domingo JL, et al., Influence of maternal stress on the effects of prenatal exposure to methylmercury and arsenic on postnatal development and behavior in mice: a preliminary evaluation, Physiol Behav 1997; 61: 455-459. http://www.ncbi.nlm.nih.gov/pubmed/9089766
- Yin K, Watanabe C, Inaba H, et al., Growth and behavioral changes in mice prenatally exposed to methylmercury and heat, Neurotoxicol Teratol 1997; 19: 65-71. http://www.ncbi.nlm.nih.gov/pubmed/9088012
- Dore FY, Goulet S, Gallagher A, et al., Neurobehavioral changes in mice treated with methylmercury at two different stages of fetal development, Neurotoxicol Teratol 2001; 23: 463-472. http://www.ncbi.nlm.nih.gov/pubmed/11711249
- Kakita A, Wakabayashi K, Su M, et al., Distinct pattern of neuronal degeneration in the fetal rat brain induced by consecutive transplacental administration of methylmercury, Brain Res 2000; 859: 233-239. http://www.ncbi.nlm.nih.gov/pubmed/10719069
- Sakamoto M, Wakabayashi K, Kakita A, et al., Widespread neuronal degeneration in rats following oral administration of methylmercury during the postnatal developing phase: a model of fetal-type minamata disease, Brain Res 1998; 784: 351-354. http://www.ncbi.nlm.nih.gov/pubmed/9518689
- Newland MC, Rasmussen EB, Aging unmasks adverse effects of gestational exposure to methylmercury in rats, Neurotoxicol Teratol 2000; 22: 819-828. http://www.ncbi.nlm.nih.gov/pubmed/11120387
- Rossi AD, Ahlbom E, Ogren SO, et al., Prenatal exposure to methylmercury alters locomotor activity of male but not female rats, Exp Brain Res 1997; 117: 428-436. http://www.ncbi.nlm.nih.gov/pubmed/9438710
- Goulet S, Dore FY, Mirault ME, Neurobehavioral changes in mice chronically exposed to methylmercury during fetal and early postnatal development, Neurotoxicol Teratol 2003; 25: 335-347. http://www.ncbi.nlm.nih.gov/pubmed/12757830
- Kim CY, Nakai K, Kasanuma Y, et al., Comparison of neurobehavioral changes in three inbred strains of mice prenatally exposed to methylmercury, Neurotoxicol Teratol 2000; 22: 397-403. http://www.ncbi.nlm.nih.gov/pubmed/10840183
- Watanabe C, Yin K, Kasanuma Y, et al., In utero exposure to methylmercury and Se deficiency converge on the neurobehavioral outcome in mice, Neurotoxicol Teratol 1999; 21: 83-88. http://www.ncbi.nlm.nih.gov/pubmed/10023805
- Chakrabarti SK, Bai C, Effects of protein-deficient nutrition during rat pregnancy and development on developmental hindlimb crossing due to methylmercury intoxication, Arch Toxicol 2000; 74: 196-202. http://www.ncbi.nlm.nih.gov/pubmed/10959792
- Zanoli P, Truzzi C, Veneri C, et al., Prenatal exposure to methylmercury during late gestation affects cerebral opiatergic system in rat offspring, Environ Res 1997; 74: 48-53. http://www.ncbi.nlm.nih.gov/pubmed/9339214
- Haykal-Coates N, Shafer TJ, Mundy WR, et al., Effects of gestational methylmercury exposure on immunoreactivity of specific isoforms of PKC and enzyme activity during post-natal development of the rat brain, Brain Res Dev Brain Res 1998; 109: 33-49. http://www.ncbi.nlm.nih.gov/pubmed/9706389
- Szasz A, Barna B, Szupera Z, et al., Chronic low-dose maternal exposure to methylmercury enhances epileptogenicity in developing rats, Int J Dev Neurosci 1999; 17: 733-742. http://www.ncbi.nlm.nih.gov/pubmed/10568690
- Watanabe C, Yoshida K, Kasanuma Y, et al., In utero methylmercury exposure differentially affects the activities of selenoenzymes in the fetal mouse brain, Environ Res 1999; 80: 208-214. http://www.ncbi.nlm.nih.gov/pubmed/10092441
- Watanabe C, Kasanuma Y, Dejima Y, et al., The effect of prenatal methylmercury exposure on the GSH level and lipid peroxidation in the fetal brain and placenta of mice, Tohoku J Exp Med 1999; 187: 121-126. http://www.ncbi.nlm.nih.gov/pubmed/10228983
- Thompson SA, White CC, Krejsa CM, et al., Modulation of glutathione and glutamate-L-cysteine ligase by methylmercury during mouse development, Toxicol Sci 2000; 57: 141-146. http://www.ncbi.nlm.nih.gov/pubmed/10966520
Ⅲ-5 歯科用アマルガムによる健康影響に関するレビュー
1. はじめに
口腔は食物摂取、咀嚼、嚥下、発音などを営むきわめて重要な器官である。これらの機能を営むのに必要な歯、顎および周囲組織がなんらかの原因によって先天的あるいは後天的に欠損や異常を生じたときには、機能障害を起こすばかりでなく、外観を損ない、また精神的にも好ましくない結果が生じる。これらの異常に対して、失った機能を回復し、あわせて審美性を回復するために歯科用アマルガムによる修復が行われる。歯科用アマルガムには銀を主成分とする合金と水銀との、いわゆる銀アマルガムが主に用いられている。アマルガム修復は操作性が簡便で、物理的性質が他の成形歯冠修復材料よりも優れている点が多いため、成形歯冠修復材料として多用されていたが、近年、環境への水銀汚染やアレルギーを始めとする生体への有害性が危惧されるために、その使用頻度は減少している。さらにアマルガム修復材から放出される水銀蒸気が一般集団における水銀曝露の大きな要因となっており、その健康影響が欧米諸国では大きな社会問題となっている。
2.歯科用アマルガムによる環境汚染
大気への水銀放出源には、火山、温泉、地熱活動などの自然的な発生源の他に、ゴミ焼却場、火力発電所、汚水処理場などの人為的な発生源が知られている。Millsら1)は、歯科治療にも用いられたアマルガム修復材の水銀が死後、火葬により大気中に放出され、これが人為的な水銀放出源になることを報告している。歯科用アマルガムに使用される水銀は、スウェーデンでは年間5~7.5トン2)、米国では90~100トン3),4)、日本では2~3トン5)と見積もられている。火葬時の炉内の温度は700~800℃まで上昇するため歯科アマルガム修復材に含まれる水銀は火葬中にすべて大気中に放出される。Morner&Nilssonはスウェーデンの総火葬数約5,000回から170~140 kgの金属水銀が放出されると推定している2)。Millsら1)はイギリス人のアマルガム修復本数を約5本と試算し、そして大人1人当たり歯に詰められるアマルガム修復材中の水銀含量を測定したところ0.6gであった報告している。この結果をもとに、イギリスの年間の火葬回数約3,700回から水銀の火葬場から放出量を11 kgと計算している。日本では、吉田ら5)が川崎市内の火葬場から放出される水銀量を推定している。この火葬場の年間火葬回数と日本人のアマルガム修復材の処置割合から、年間の水銀放出量は最大で9.4 kgであろうと推定している。この数値を1日当たりに換算すると26gの放出量であるが、ゴミ焼却場から放出される水銀量より少なく、火葬場は人為的水銀汚染源として大きく寄与するものではないと結論づけている。
3.歯科用アマルガムからの水銀の取り込み
歯科用アマルガムに使用される金属水銀は蒸気圧が高いため、室温でも容易に蒸発し、水銀蒸気となる。水銀蒸気を吸入した場合、肺胞から約80%が吸収され血流中に取り込まれ、無機水銀イオンに素早く酸化される。歯科用アマルガムから水銀蒸気が発生する。歯科用アマルガムを充填している患者の口腔中の水銀蒸気濃度はアマルガムを充填いていない対照者と比べると高い6)。しかも口腔内の水銀濃度は咀嚼によりさらに上昇し、咀嚼を中止することによりアマルガムからの水銀蒸気の発生が減少する。とくに一般的な食べ物を噛むときより、ガムを噛むことにより、水銀蒸気の発生量がさらに増加する7)。口腔内で発生した水銀蒸気は体内への水銀の取り込みを増加させる。またこの水銀蒸気は唾液に溶け、嚥下により体内に吸収される。Frykholm8)は放射性水銀トレーサーを用いて、ヒトや動物に水銀アマルガムを充填後、尿および糞中の水銀濃度が有意に上昇することが見出した。Molinら9) やAbrahamら10) はアマルガム充填者の血液中水銀濃度はアマルガム充填本数や表面面積と高い相関関係が認められることを報告している。
歯科用アマルガム充填者の死亡後の剖検例では、アマルガム充填者の水銀濃度がアマルガムを充填していない対照者に比べ、後頭皮質で約2倍、腎臓で約10倍と高いことが報告されている11)。Eggleston&Nylanderもアマルガム充填者の脳の灰白質や白質の水銀濃度が対照者に比べ、高いことを報告している12)。しかも、歯科用アマルガム修復材の本数やアマルガムの表面面積が脳や腎臓の水銀含量との間に相関関係があることが明らかにされている。水銀アマルガムに起因する水銀の1日摂取量の推定が多くの研究者によって行われている。アマルガムからの水銀摂取量は3.0-17.0 μg/dayと推定され2)、食物、水、空気から摂取する水銀量よりも高く、一般環境の中で主な水銀曝露源であるといえる (表1)。
| 曝露源 | μ gHg/1日 |
|---|---|
| 歯科アマルガム | 3.1−17.0 |
| 魚介類 | 2.34 |
| 他の食物 | 0.25 |
| 水 | 0.0035 |
| 空気 | 0.001 |
歯科用アマルガムから発生した水銀蒸気の胎盤透過について、Vimyら13) は妊娠112日目の羊の歯牙12本に放射性水銀のアマルガムを充填し、母体と胎児の水銀濃度について調べた。アマルガム装着後2日以内に臍帯血や羊水中の水銀濃度が最高に達し、研究期間中その濃度が持続することを示した。母体では水銀は主に腎臓と肝臓に蓄積し、胎児では最も高い濃度が肝臓と脳下垂体に見出されている。またTakahashiら14) も妊娠2日目にラットの歯牙に1本の水銀アマルガムを充填したのち、妊娠20 日目の母体の水銀濃度は脳、肝、肺、胎盤では、対照群に比べ3-6倍高く、腎では20倍高値を示した。胎児では肝臓中の水銀濃度が最も高く、対照群の約2倍の値を示した。これらの研究は歯科用アマルガム充填剤から発生した水銀蒸気が、胎盤関門を通過し胎児へ移行することを示唆している。Yoshidaら15) は胎仔の肝臓に蓄積した水銀は主に金属結合蛋白質であるメタロチオネインと結合して存在していることを見出している。これに対し、母体の肝臓ではほとんどの水銀は高分子の蛋白質と結合している。胎仔の肝メタロチオネインは、胎仔における水銀毒性の軽減に関与しているかもしれない。しかしながら、出産後、新生仔の肝メタロチオネイン量の低下に伴い、肝臓中水銀は低下し、反対に脳、腎の水銀濃度は著しい増加が認められ、水銀の再分布が生じ、新生児の発育・発達へ影響が危惧されている16)。
4.歯科用アマルガムと健康影響
歯科用アマルガムと水銀アレルギーの発症に関して、1928年にFleischmannが口内炎や肛門湿疹を報告17)したのが最初であるとされている。我が国においては1972年に中山ら18) が水銀と亜鉛によるアレルギー症状としての扁平苔癬を報告して以来、皮膚科領域からの臨床報告がなされている。パッチテストはアレルギー性接触皮膚炎の診断として広く用いられている。塩化第二水銀、金属水銀、チメロサールを抗原として用いたパッチテストによる水銀陽性率について、1968年の第3回パッチテスト研究会では塩化第二水銀0.1%試験濃度で健常者を含めた陽性率が15.4%と報告している19)。また、駒村ら20)は皮膚科来院患者を対象とし0.1%試験濃度で7.6%、健常者および金属アレルギーが疑われる疾患を有する有病者を対象とした全国的な調査結果では0.05%試験濃度で8.0%、12.4%、0.1%試験濃度では11.1%、19.3%の陽性率であり、有病者の陽性率が高いことが報告されている21)。また、鈴木ら22) は皮膚科来院患者を対象とし0.05%試験濃度で8.1%、森ら23) は医科大学学生を対象とした0.05%試験濃度で13.0%と報告している。山中ら24) は試験濃度と陽性率について歯科大学学生を対象として検討し、0.05%試験濃度で7.7%、0.1%試験濃度で12.0%、0.14%試験濃度では19.2%と濃度の上昇とともに陽性率が高くなることを報告し、この傾向は調査した他の9種類の金属にも認められることから、高濃度になるとアレルギー反応のみならず一次刺激による皮膚反応も現れるためと考察している。また、1%金属水銀では11.8%、有機水銀のチメロサールでは17.3%であり、同時に行った0.1%塩化第二水銀の9.6%よりも高く、金属の化学形態によっても差がみられる。水銀の陽性率は報告者、抗原および濃度の種類により異なるが、水銀の陽性率は試験液として0.05%塩化第二水銀、健常者を対象とした場合、その範囲は7.7~13.0%であるといえる。0.1%塩化第二水銀溶液は刺激作用がみられることから市販されている試験溶液の濃度は現在、0.05%に変更されている。アマルガム修復と水銀感作についてWhite&Brandtら25) はアマルガムに接する機会の多い歯学部学生において高学年になるにつれて感作率が高くなると報告している(0.1%塩化第二水銀使用)。また、森ら23) は水銀感作について感作者と非感作者とでは尿中水銀量に差はみられないが毛髪中水銀濃度は感作群が高く、毛髪中水銀が水銀感作に量的関連のあることを示唆している。また、水銀に感作している者は金属を用いて治療している本数が有意に多いことを報告しているが、アマルガム修復に関する本数は不明である。これらのことに関して、山中ら24) は歯学部学生の水銀感作率は他の報告と同程度であること、またアマルガム充填の有無と感作率では差はみられないことなどから、水銀感作の要因としてアマルガムが大きく関わっているとは考え難く、むしろ幼少時からのマーキュロクロムや予防接種薬中のチメロサールなどによる感作の可能性の方が大きいと考察している。また、濱野らの報告26) によると、金属アレルギーを疑われた患者の口腔内には金属を用いた歯冠補綴物が多く、口腔内の金属修復物が多いことにより、アレルゲンとなりうる金属に接する確立が高くなるが、単に修復物が多いということがアレルギー発症の原因になるとはいえないであろうと述べている。
我が国のアマルガム修復の割合は財団法人厚生統計協会から毎年、発行されている社会医療診療行為別調査報告によると1970年では78.5%であり、口腔内に充填された成形歯冠修復材料10個の内、およそ8個がアマルガムで、1年間のアマルガム修復数は概算すると900万であった。1970年以後アマルガム修復は減少し、1999年にはアマルガム修復の占める割合は3.7%で、1年間のアマルガム修復数は概算で260万である。アマルガムの修復数に関する諸外国のデータは少ないが、デンマークにおける報告を概算するとアマルガム修復数は1980年では330万、1996年には150万まで減少している27)。これらの数値を人口で割ると、我が国では0.02(1999年)、デンマークでは0.29(1996年)となり、100人当たりで計算すると我が国では2個、デンマークでは29個のアマルガム修復が行われていることになる。我が国におけるアマルガム修復は減少の一途を辿っており、アマルガム修復が原因と考えられる水銀アレルギーの発症は減少すると考えられる。しかしながら、レジン修復の場合、使用されるレジン系材料によるアレルギー27)、あるいは内分泌撹乱物質として作用するとの指摘もあり28)、今後の課題として残されている。セメント修復は生体に対する副作用が少ない材料であるが、アマルガム修復あるいはレジン修復と比べて強さ、耐久性に劣るために適応範囲が制限される欠点を有する。
職業上、歯科医や歯科助手は水銀蒸気に曝露される。歯科診療所の気中水銀濃度は平均 20-30μg/m3、高いところでは150-170 μg/m3と報告されている。Nixonら29) やNalewayら4) は歯科医や歯科助手の尿中水銀濃度を測定した結果では、その分布はかなり広く、100 μg/l以上の値も見られている。尿中水銀濃度からも歯科診療所内の環境中水銀濃度は幅広いことが明らかである。歯科用アマルガムによる口腔内の水銀蒸気濃度について、Pattersonら30) は歯ブラシを行うことにより水銀蒸気濃度が平均8.2(0.1-62) μg/m3 になることを報告している。Vimyら6)は口腔内の水銀蒸気濃度が咀嚼開始10分後に29.8μg/m3と43μg/m3 となり、その後プラトーに到達することを示した。歯科用アマルガムからの1日当たりの水銀曝露量が口腔内の水銀濃度、血液や尿中水銀濃度から推定されている。Clarksonら31)はこれまでの研究データから10 μg/日と推定し、これに対し、Olsson&Bergman32)は8本以上のアマルガム充填者でも水銀曝露量は1-2 μg/日と推定している。その量は研究者により異なるが1-10 μg/日の範囲内にある。水銀歯科用アマルガム充填者の血液中水銀値は対照者の比べて高い。しかも全血や血漿中水銀濃度がアマルガム表面に相関することを報告されている。しかしながら、Langworthら33)は全血中水銀濃度が魚介類の摂取量と相関し、アマルガム充填本数との間には相関は見られないと述べている。Snappら34) やMolinら9) はアマルガム修復材を除去することにより血中水銀濃度が低下することを報告している。歯科用アマルガム充填者の尿中水銀排泄量もまたアマルガム充填本数と相関する。Skareら35) は1日当たりの尿中排泄量を80 ng/アマルガム表面と推定し、これは40アマルガム表面を持つヒトでは尿中水銀排泄量は3.2 μg/日に相当する。またKingmanら36)はアマルガム充填本数と水銀の尿中排泄と相関し、10本のアマルガムの充填で、尿中水銀排泄量が1 μg/l上昇すると推定しているが、尿中水銀濃度は、決して中毒レベルまでは達しないと述べている。しかし、常に咀嚼しているアマルガム充填者の尿中水銀濃度は高い。Sällstenら37)はニコチンガム咀嚼者の尿中水銀濃度は5~25 μg/gクレアチニンであったことを示し、この濃度はACGIHが最近提唱した職業性水銀蒸気曝露の勧告限界値25μ g/m3に対応する尿中水銀濃度35 μ g/gクレアチニン2)より低濃度であると述べている。
職業性水銀曝露をうける歯科診療従事者の健康影響に関する報告は多いが、歯科アマルガム修復材からかの水銀蒸気曝露による影響に関する報告は少ない。Ahlqwistら38) は歯科アマルガム充填者の健康影響に関する疫学調査では、アマルガム充填本数と自覚症状の数や特定の症状や愁訴の有症率との間には関連性は見られなかったと述べている。さらに1968-1969年に始めた1462人のスウェーデンの女性のコホート研究では、1974-1975年、1980-1981年そして1992-1993年の追跡調査でも、血清中水銀濃度とアマルガム充填数と相関するが、糖尿病、心筋梗塞、熱中症、癌の罹患率との間に関連性は見られてない39)。Michelら40) も水銀中毒に見られる疲労感とアマルガム本数との間に関連性は見られないと述べている。Aronssenら41) は歯科用アマルガムに関連した自覚症状を訴えた10名と、アマルガムの状況そして年齢を一致させた対照10名について調査した結果、ガム咀嚼前後の口腔内水銀蒸気濃度や尿中水銀濃度と尿中総蛋白排泄量と関係について、差異は認められなかったと述べている。
歯科用アマルガム充填による腎機能への影響に関する研究では、Boydら42) は12本のアマルガム充填を行った羊に60%の糸球体ろ過率 (GFR) の低下を認め、水銀による腎機能への影響を示唆した。しかしながら、この研究では腎組織の形態学的変化や血清尿素窒素の増加はみられていない。歯科用アマルガム充填者の調査では、Etiら43) はアマルガム充填者の尿中NAG排泄量が非充填者に比べ高値であった述べ、アマルガムから遊離される水銀に腎への影響を示唆している。これに対し、Herrstömら44) は尿中のアルブミン、β-ミクログロブリン、ミクログロブリン-L鎖やN-アセチル-β-グルコサミニダーゼ (NAG) 排泄量はアマルガムや尿中水銀排泄とは関連性は認められず、アマルガム充填による腎機能の低下は起こらないと述べている。Sandborgh-Englundら45) も歯科用アマルガム充填者のアマルガム除去前後の尿や血中水銀濃度の変化や尿中β2-マイクログロリン、クレアチニン、NAG、アルブミンの排泄量や51Cr-EDTAによる糸球体ろ過率などの腎機能を調べている。アマルガム除去後、血液、血漿そして尿中水銀濃度は低下したが、調べた腎機能の検査項目すべてに変化なく、アマルガム充填剤から遊離される水銀による腎毒性は認められていない。このように歯科用アマルガムからの水銀曝露による健康影響に関する報告は否定的な報告が多い。しかしながら、より規模の大きな人口集団が低濃度の水銀に曝露されたとき、水銀に対する感受性の高いヒトには影響が出る可能性は排除できないと思われる。
近年、水銀蒸気は中枢神経系に対し毒性を示すことから、歯科用アマルガムから発生する水銀蒸気が変性疾患である筋萎縮性側索硬化症、アルツハイマー病、パーキンソン病や多発性硬化症を悪化させる要因ではないかと考えられている。事実、アルツハイマー病患者の剖検例の脳内水銀量46) は健常者より高値であるという報告がなされている。Hockら47) も、初期のアルツハイマー病患者の血液中水銀濃度は健常者に比べて3 倍高値であったと述べている。これに対し、Fungら48) はアルツハイマー病患者と健常者の間には血液中水銀濃度や血液中水銀/セレン比に差異は見られないと述べている。同様に脳内水銀についてもアルツハイマー病患者と健常者の間に差がないという否定的な報告49),50)も多くなされており、変性疾患と歯科用アマルガムとの因果関係について明確な結論は出ていない。
5.今後の問題点
歯科アマルガムから発生される水銀蒸気曝露は、WHO2) の職業性水銀蒸気曝露の勧告限界値25μg/m3 より低い濃度である。このような低濃度の長期間の水銀蒸気曝露による生殖器や胎児への影響については、ほとんど研究がなされていない。今後、低濃度曝露による水銀の胎盤透過、胎盤機能への影響、胎児毒性、および行動異常を含めた胎児の発達障害、変性疾患との関連性などが解明すべき問題となると考える。
引用文献
- Mills A (1990) Mercury and crematorium chimneys. Nature. 346:615. http://www.ncbi.nlm.nih.gov/pubmed/2104514
- WHO (1991) Environmental Health Criteria 1. Inorganic mercury, Geneva, World Health Organization. 1990:1-168.
- Wolff M, Osborne J and Hanson AL (1983) Mercury toxicityand dental amalgam. Neurotoxicology. 4:201-201.
- Nalway C, Sakaguchi R, Mitchell E, Muller T, Ayer WA and Hafferren JJ (1985) Urinary mercury levels in US dentists, 1975-1983. Review of health assessment program. J. Am. Dent Assoc. 111:37-42. http://www.ncbi.nlm.nih.gov/pubmed/3861682
- 吉田 稔、岸本 剛、山村行夫、田伏末男、赤間美文、佐藤 洋 (1994) 環境汚染物質としての歯科用アマルガム 特に火葬場から放出される水銀量について、日本公衛誌、41:618-624 http://www.ncbi.nlm.nih.gov/pubmed/7919469
- Vimy MJ and Lorsheider FL (1985) Serial measurements of intra-oral air mercury: estimation of daily dose from dental amalgam. J. Dent. Res. 64:1072-1075. http://www.ncbi.nlm.nih.gov/pubmed/3860539
- Berglund A (1990) Estimation by a 24-hour study of the daily dose of intra-oral mercury vapor inhaled after release from dental amalgam. J Dent Res. 69:1646-1651. http://www.ncbi.nlm.nih.gov/pubmed/2212208
- Frykholm KO (1957) Mercury from dental amalgam. Its toxic and allergic effect and some comments on occupational hygine. Acta Odont Scand. 22:1-108.
- Molin M, Bergman B, Marklund SL, Schütz A and Skerfving S (1990) Mercury, selenium, and glutathione peroxidase before and after amalgam removal in man. Acta Odont Scand. 48:189-202. http://www.ncbi.nlm.nih.gov/pubmed/2368614
- Abraham JE, Svare CW and Frank CW (1984) The effect of dental amalgam restorations on blood mercury levels. J Dent Res. 63:71-73. http://www.ncbi.nlm.nih.gov/pubmed/6582086
- Nylander M, Friberg L and Lind B (1987) Mercury concentrations in the human brain and kidneys in relation to exposure from dental amalgam fillings. Swed. Det. J. 11:179-187 http://www.ncbi.nlm.nih.gov/pubmed/3481133
- Eggleston DW and Nylander M (1987) Correlation of dental amalgam with mercury in brain tissue. J Prosthet Dent. 58:704-707. http://www.ncbi.nlm.nih.gov/pubmed/3480359
- Vimy MJ, Takahashi Y and Lorsheider FL (1990) Maternal-fetal distribution of mercury (203Hg) released from dental amalgam fillings. Am. J. Physiol. 258 (Regulatory Integrative Comp. Physiol. 27), R939-R945. http://www.ncbi.nlm.nih.gov/pubmed/2331037
- Takahashi Y, Tsuruta S, Hasegawa J, Kameyama Y and Yoshida M (2001) Release of mercury from dental amalgam fillings in pregnant rats and distribution of mercury in maternal and fetal tissues. Toxicology 163:115-126. http://www.ncbi.nlm.nih.gov/pubmed/11516521
- Yoshida M, Aoyama H, Satoh H and Yamamura Y (1987) Binding of mercury to metallothionein-like protein in fetal liver of the guinea pig following in utero exposure to mercury vapor. Toxicol Let. 37:1-6. http://www.ncbi.nlm.nih.gov/pubmed/3590224
- Yoshida M, Satoh H, Kojima S and Yamamura Y (1990) Retention and distribution of mercury in organs of neonatal guinea pigs after in utero exposure to mercury vapor. J Trace Elements Exp. Med. 3:219-226.
- Thomson J and Russel JA (1970) Dermatitis due to mercury following amalgam dental restorations. Br. J. Derm. 82:292-297. http://www.ncbi.nlm.nih.gov/pubmed/4245563
- 中山秀夫,大城晶子,佐藤重臣,中野直也 (1972) 歯科金属のアレルギーによると思われる扁平苔癬の2例について. 耳鼻咽喉科. 44:239-237.
- 川村太郎 (1968) 第3回パッチテスト研究会. アレルギー. 17:676-691.
- 駒村公美,小塚雄民,藤本圭一,橋本誠一,片岡葉子,田代 実,吉川邦彦 (1989) 歯科金属20 種類によるパッチテスト成績. 皮膚.31:268-272.
- 井上昌幸 (1993) 金属アレルギーの現状と歯科領域における対応.補綴誌. 37: 1127-1138.
- 鈴木真理, 早川律子 (1992) 金属パッチテストの陽性頻度. 皮膚. 34:35-43.
- 森 富男,平井敏之,富山 猛,飯田和質,宮越伸治,佐藤一博,日下幸則,柳原 誠,上田恵一 (1998) 水銀感作に関連する環境からの暴露. 日衛誌. 52:661-666.
- 山中すみへ,太田 薫,高柳篤史,野村登志夫,高江洲義矩 (1997) 歯科用金属によるアレルギーのスクリーニング法としてのパッチテスト. 口腔衛生会誌. 47:27-35.
- White RR and Brandt RL (1991) Development of mercury hypersensitivityamong dental students. JADA, 92:1204-1207. http://www.ncbi.nlm.nih.gov/pubmed/1064642
- 濱野英也 (1998) 金属アレルギーと口腔内修復物の成分組成に関する研究. 口病誌. 65:93-99.
- Arenholt-Bindslev D. Environmental aspects of dental filling materials, Eur. J. Oral. sci. 1998; 106: 713-720. http://www.ncbi.nlm.nih.gov/pubmed/9584905
- Olea , N., Pulgar, R., Perez, P., Olea-serrano, F., Rivas, A., Novillo-Fertrell, A., Pedraza, V., Soto, A.M., Sonnenschein, C (1996) Estrogenicity of resin-based composites and sealants used in dentistry, Environm. Health Perspectives. 104:298-305. http://www.ncbi.nlm.nih.gov/pubmed/8875145
- Nixon GS, Whittle CA, Woodfin A (1981) Mercury levels in dental surgeries and dental personnel. Br Dent J. 151:149-154.
- Patterson JE, Weissberg BG and Dennison PJ (1985) Mercury in human breath from dental amalgams. Bull Environm Contam Toxicol. 34:459-468. http://www.ncbi.nlm.nih.gov/pubmed/3986383
- Clarkson TW, Friberg L, Hursh JB and Nylander M. (1988) The prediction of intake of mercury vapor from amalgams. In: Clarkson TW., Friberg L., Nordberg GF., Sanger P. eds. Biological monitoring of metals. New York: Plenum Press, pp247-264.
- Olsson S., Bergman M. (1992) Daily dose calculations from measurement pf intra-oral mercury vapor. J. Dent Res. 71:414-423. http://www.ncbi.nlm.nih.gov/pubmed/1556301
- Langworth S, Elinder C-G, Åkesson A (1988) Mercury exposure from dental amalgam. I. Mercury concentrations in blood and urine. Swed Dent J. 12:69-70. http://www.ncbi.nlm.nih.gov/pubmed/3164918
- Snapp KR, Boyer DB, Peterson LC and Svare CW (1989) The contribution of dental amalgam to mercury in blood. J Dent Res. 68:780-785. http://www.ncbi.nlm.nih.gov/pubmed/2715470
- Skare I, Bergström T, Engoqvist A and Weiner JA. (1990) Mercury exposure of different origins among dentists and dental nurses. Sacand J Work Environ Health. 16:340-347. http://www.ncbi.nlm.nih.gov/pubmed/2255875
- Kingman A, Albertini T and Brown LJ (1998) Mercury concentrations in urine and whole blood associated with amalgam exposure in a US military population. J Den Res. 77(3):461-71. http://www.ncbi.nlm.nih.gov/pubmed/9496919
- Sällsten G, Thorén J, Barregärd L, Schütz A and Skarping G. (1996) Long-term use of nicotine chewing gum and mercury exposure from dental amalgam fillings. J Dent Res. 75:597-598. http://www.ncbi.nlm.nih.gov/pubmed/8655765
- Ahlwist M, Bengtsson C, Furunes B, Hollender L and Lapidus L. (1988) Number of amalgam tooth fillings in relation to subjectively experienced symptoms in a study of Swedish women. Community dent oral Epidemiol. 16:227-231 http://www.ncbi.nlm.nih.gov/pubmed/3165750
- Ahlwist M, Bengtsson C, Lapidus L, Gergdahl A. and Schuta A. (1999) Serum mercury concentration in relation to survinal, symptoms and disease: results from a prospective population study of women in Gothenburg, Sweden. Acta Odontol Scand 57:168-174. http://www.ncbi.nlm.nih.gov/pubmed/10480284
- Michel I, Norbäck D and Edling C (1989) An epidemiologic study of the relation between symptoms of fatigue, dental amalgam and other factors. Swed Dental J.13:33-38. http://www.ncbi.nlm.nih.gov/pubmed/2734698
- Arosson A-M, Lind B, Nylander M and Nordberg M.(1989) Dental amalgam and mercury. Biol Metals. 2, 25-30.
- Boyd ND, Benediktsson H, Vimy MJ, Hooper DE and Lorscheider FL (1991) Mercury from dental “silver” tooth fillings impairs sheep kidney function. Am J Physiol. 261:R1010-R1014. http://www.ncbi.nlm.nih.gov/pubmed/1928419
- Eti S, Weusman R, Hoffman R and Reidenberg MM.(1995) Slight renal effect of mercury from amalgam filling. Pharmacol Toxicol. 1995; 76:47-49. http://www.ncbi.nlm.nih.gov/pubmed/7753757
- Herrstöm P, Schüta A, Raihle G, Holthuis N, Högested B and Råstam L. (1995) Dental amalgam, Low-dose exposure to mercury, and urinary proteins in young Swedish men. Arch Environm Hlth. 1995; 50:103-107. http://www.ncbi.nlm.nih.gov/pubmed/7786045
- Sandborgh-Englund G, Nygren AT, Ekstrand J and Rlinder C-G (1996) No evidence of renal toxicity from amalgam fillings. Am J Physiol. 271:R94-R941-5. http://www.ncbi.nlm.nih.gov/pubmed/8897985
- Tompson CM, Markesbery WR, Ehman ED, Mao YX and Vance DE. (1988) Regional brain trace-element studies in Alzheimer`s disease. Neurotoxicol. 9:1-7. http://www.ncbi.nlm.nih.gov/pubmed/3393299
- Hock C, Drasch G, Golombowski S. Muller-Spahm F, Willershausen-Zonnchen B, Schwarz P, Hock U, Growdon JH and Nitsch RM (1988) Increased blood mercury levels in patients with Alzheimer`s disease. J. Neural. Transm. 105:59-68. http://www.ncbi.nlm.nih.gov/pubmed/9588761
- Fung YK, Meade AG, Rack EP, Blotcky AJ, Claassen JP, Beatty MW and Durham T. (1995) Determination of blood mercury concentrations in Alzheimer`s patients. J. Toxicol. Clin. Toxicol. 33:234-247. http://www.ncbi.nlm.nih.gov/pubmed/7760449
- Cornett CR, Markesbery WR and Ehman WD (1998) Imbalances of trace elements related to oxidative damage in Alzheimer`s disease brain. Neurotoxicology 19:339-345. http://www.ncbi.nlm.nih.gov/pubmed/9621340
- Saes SR, Wekstein MW, Kryscio RRJ, Henry RG, Cornett CR, Snowdon DA, Grant FT, Schmitt FA, Donegam SJ, Wekstein DR (1999) Alzheimer`s disease, dental amalgam and mercury. J Am Den Assoc 130: 191-199. http://www.ncbi.nlm.nih.gov/pubmed/10036842
Ⅲ-6 ワクチンに含まれるチメロサールのリスク評価と今後の対応
チメロサールは、薬剤の防腐剤として、とりわけワクチンの保存剤として広く使用されてきた。チメロサールが水銀を含有していること、また新生児や幼児に義務付けられているワクチンに使用されていることから、数年前からアメリカでチメロサールの健康影響についての議論が盛んになった。本報では、ワクチンに含まれるチメロサールのリスク評価の検証と各国・日本の最近の動向および、今後の対応について考察を試みた。
1. チメロサールとは
チメロサール(thimerosal)、水銀を含む有機化合物であり、その殺菌作用は、昔から知られており、1930年代から、種々の薬剤に保存剤として使われてきた。チメロサール:エチル水銀チオサリチル酸ナトリウム塩(sodium ethylmercurithiosalicylate) 、その化学的構造は、図に示す通りであり(図1)、分子量404.81は、水銀(Hg)の原子量が200.59であるから、チメロサールの重量の約半分(49.55%)を水銀の重量が占めていることになる。チメロサールは、体内でエチル水銀(ethylmercury)とthiosalicylateとに分解し、エチル水銀の部分で人体への毒性が心配されている。
ワクチンには 1940年ころから保存剤として使われ始め、生きているウイルスや菌が入っている生ワクチンでは使われないが、死んだ菌などが入っている不活化ワクチンでは保存剤として主に使われるようになった。Bernard1)らは、近年のアメリカ合衆国(アメリカ)での自閉症の発生増加を水銀と関連していると説明しようとした。この十数年の間にアメリカでは、乳幼児が接種すべきワクチンの種類や本数が増え、より月齢が低い段階で接種を受けるようになってきていること、またその中にはチメロサールが添加されているワクチンもあり、これによるエチル水銀曝露を受ける可能性があること、そして自閉症の症状と水銀中毒の症状の類似性を指摘した。これに対して、2001年10月米国科学アカデミーの医学協議会(Institution Of Medicine : IOM)は、予防接種安全性検討委員会で、「チメロサールを含むワクチンと神経発達障害」について検討し、チメロサールを含むワクチンの接種を受けることと神経発達障害とが関係しているという仮説は、立証されていないが、もっともらしく思われる。しかしながら、「チメロサールを含むワクチンの接種を受けることと自閉症・注意欠陥多動性障害(ADHD:attention deficit/hyperactivity disorder)・言語発達障害などの神経発達障害との間の因果関係については、肯定するにも否定するにも十分な証拠がない。」と結論を示した。以上のような結論を踏まえ、IOMは、チメロサールを含まないワクチンを勧告した。2)
2. チメロサールのリスク評価
アメリカで米国食品医薬品局 (Food and Drug Administration: FDA)が1999年に、行ったワクチンに含まれるチメロサールのヒトに対するリスク評価について以下に示す3)。リスク評価は、有害性の確認、量反応評価、曝露量の評価、リスクの判定の4つから構成される。
①有害性の確認 hazard identification:チメロサールの有害性として、まずアレルギーとしての遅延性過敏反応が知られている。これは主に水銀化合物に関連するが、thiosalicylate成分が決定因子だという人もいる。高濃度曝露の影響としては神経毒性と腎毒性がある。ヒトへの低濃度チメロサール曝露後の毒性についてはまだあまり知られていない。しかし、チメロサールの高濃度曝露の毒性は、メチル水銀の高濃度曝露の毒性に匹敵し、またエチル水銀とメチル水銀の化学構造が類似していることから、チメロサールの代謝物であるエチル水銀の毒性とメチル水銀の毒性は似ていると考えることは妥当であるとしている(この仮定の妥当性については後述)。
②量反応評価 dose-response assessment:ワクチン内のエチル水銀量が考慮すべきレベルに達しているかを決めるのにメチル水銀の曝露に対するガイドラインが使われた。各機関が出しているメチル水銀の安全基準値は、EPA (Environmental Protection Agency)では0.1μg/kg体重 / 日、ATSDR(Agency for Toxic Substance and Disease Registry)では 0.3μg/kg体重/ 日、FDA では 0.4μg/kg 体重 / 日、WHOでは0.47μg/kg 体重 / 日であり、各々違っている。そしてこの基準値を特に多くのワクチンを接種する時期である出生後~生後26週 (6ヶ月)の女児の5th,50th,95th percentileの体重に適用し、水銀の累積限界曝露量(表1)を計算した。
③曝露量の評価 exposure assessment:曝露量については、米国内の推奨小児予防接種スケジュール(Recommended US childhood immunization schedule)のワクチンに含まれる水銀量で評価を行った4)。生後6ヶ月までに接種されるワクチンの中で、チメロサールが含まれるワクチンの種類は、3種混合(DTaP)、インフルエンザb 型菌ワクチン (Hib)、B型肝炎ワクチン(HB)とインフルエンザワクチン(インフルエンザワクチンは特定のリスクファクターを持つ子供にのみ接種が推奨される)である。各ワクチンに含まれるチメロサール量は、DTaPでは~25μg(水銀)以下/0.5ml(一回あたりのワクチンの量)、Hibでは、25μg 以下、 HepatitisBでは ~12.5μg 以下、(Influenzaでは12.5μg 以下)である。そして、生後6ヶ月までのワクチンによるチメロサール曝露量を計算すると、6ヶ月までに最大で187.5μg(インフルエンザワクチンも受けると200μg)に達する(表2)。この量は表1に記したEPAの基準値を上回る。しかしながら、ATSDR、FDA、WHOの基準値は、越えていない。同様に生後2歳までの曝露量を計算してみると、その曝露量はEPAの基準値を下回る。また、DTaP、Hib、HBワクチンには、アメリカでは現在、チメロサールの含まれていないワクチンを使用することも出来る。
④リスクの判定 risk characterization:チメロサールのリスクの判定を行うと、まず遅延性過敏反応を除いてはワクチンに含まれるチメロサールの量で起きた有害な影響の証拠はない。そして、正確にリスクを同定することは、チメロサール(エチル水銀)の毒性に対する知見の不充分さのせいで現段階では困難である。しかしながら、「知見の不充分さとリスク評価の不正確性はあるが、ワクチン内のチメロサールの累積曝露による微細な神経発達異常の可能性は排除することは出来ない。」とした。
3. メチル水銀とエチル水銀の毒性比較
上述したように FDA におけるチメロサールのリスク評価において、エチル水銀(EtHg)の毒性をメチル水銀(MeHg)のそれに置き換えるという仮定が用いられた。そこでこの仮定が正しいのか、両者の毒性について比較してみる。
Magos5)らは論文(1985)の中で両者の毒性は全く同じではないと解釈できる実験結果を示している。彼らは実験の中でオス、メスのラットを3つずつのグループに分け、各グループにそれぞれMeHgCl 8.0mgHg/kg/day、EtHgCl 8.0mgHg/kg/day、EtHgCl 9.6mgHg/kg/dayを5日間、胃管を用いて投与した。そして投与終了後、各グループの体重の変化、組織(血液、脳、腎臓)中の水銀濃度、協調運動障害(flailing reflex とhind leg crossing)、組織(脳、神経、腎臓)における病理学的変化を調べた。体重の変化については、全ての投与群において、投与終了後の体重が同時期の正常なラットに期待される体重よりも低下していて、その減少率は投与後日を追うごとに高くなっていた。また多くの時期において、同じ性別内ではEtHg投与群の方がMeHg投与群より減少率が有意に高く、同じ物質を同量投与された場合では、メスよりオスの方が減少率は大きかった。投与終了3日後の血液中の水銀濃度は、無機型、有機型ともにEtHg投与群の方が高く、投与終了後10 日後には減少していた。脳と腎臓における水銀濃度は無機型ではEtHg投与群の方が高く、有機型ではMeHg投与群の方が高かった。また、どちらの組織でも投与後日数が経過しても濃度にあまり大きな変化は見られなかった。そして総水銀濃度を比較した場合、血液ではEtHgを投与した方が高くなり、脳や腎臓といった組織ではMeHgを投与した方が高くなった。協調運動障害の重症度を示すスコアはMeHg投与群の方が高くなり、これは主にflailing reflexのスコアの差によってもたらされることが分かった。小脳顆粒細胞層の細胞への影響は、EtHg 8.0mgHg/kg/day投与群では見られなかったのに対して、MeHg 8.0mgHg/kg/day投与群ではほとんどのラットで壊死細胞が観察された。脊髄後根神経節への影響はどちらの投与群においても見られたが、統計学的に有意な差は見られなかった。腎臓に対する影響は、細胞の空胞化、管腔の拡大、再生といったものだが、これはEtHgとMeHgに共通して主に近位尿細管の病理学的異常の拡大はEtHg投与群の方がより起こりやすく、またEtHg投与群にはfibrosisや異染性細胞、細胞浸潤といったMeHg投与群には見られなかったような所見もあった。これらの結果を踏まえてMagosらは、ラットにおける神経毒性はMeHgの方が強く、腎毒性はEtHgの方が強いと考えるのは妥当であると結論付けている。
このような論文を見る限り、ヒトにおいてもMeHgとEtHgの毒性には異なる点がある可能性が考えられ、先に述べたような仮定には多少の疑問が生じるのではないかと思われる。
4. リスク評価の検証
第2項でFDAによるチメロサールのリスク評価を示したが、これをBrent, J.は、次のように検証した6)。FDAはリスク評価の際に、次に挙げる3つの主な仮定を用いた。1)メチル水銀の特徴は、エチル水銀に適用できるとしたこと。2)EPAのメチル水銀の基準摂取量(RfD)はリスク判定に適切であるとしたこと。(RfDとは、EPAの基準値の呼称で、一生の間ヒトの集団が毎日曝露を受けても有害な影響のリスクがないと推測される量のことである。)3)RfDを6ヶ月間という短期間曝露におけるリスク判定に使用したことである。以上の仮定を用いた上でFDAは「生後6ヶ月の間に全ての予防接種を受けた幼児は、曝露される水銀の量がEPAのメチル水銀のRfD(0.1μg/kg/day)を越す。」と評価した。そこで、この第1の仮定が妥当かどうか、エチル水銀の毒性をメチル水銀の毒性について比較してみる。Magos5)らは、前述のように1985年の論文で、両者の毒性は、全く同じわけではないと解釈できる実験結果を示し、「ラットにおける神経毒性はメチル水銀の方が強く、腎毒性はエチル水銀の方が強いと考えるのは妥当である」と結論付けている。ヒトにおいてもメチル水銀とエチル水銀の毒性には異なる点がある可能性が考えられ、第1の仮定には多少の疑問が残るのではないかと思われる。また、第2、第3の仮定であるが、Rfdは本来、一生を通じた曝露のガイドラインの為に意図されたもので、短期間の曝露限界として利用するためのものではない。最近の傾向としてリスク評価の科学的妥当性を高めるために生理学的(薬物)動態モデル(Physiologically Based Pharmacokinetic:PBPK)計算が行われている。今回の例に適用すると、メチル水銀はL-cysteine と共有結合することによってL-methionineに似た立体配置を形成し、脳に運ばれ、neutral acid uptake pumpsによって血液脳関門を通して運ばれる。一方、エチル水銀は複合体をつくらず、同じ方法では脳に運ばれないとされている。このことから、エチル水銀の中枢神経系へのリスクはメチル水銀のそれと似ているという仮定は妥当ではない。以上のことより、FDAのリスク評価は多数の問題のある仮定の上に成り立ち、PBPKの考え方も適用されていない。
5. チメロサールに対する諸外国の最近の動向
今日、ワクチンに含まれるチメロサールとそのヒトの毒性に対する各国・各機関の動向について述べる。2000年6月に、アメリカ家庭医アカデミー(AAFP)、アメリカ小児科医アカデミー(AAP)、予防接種諮問委員会(ACIP)、公衆衛生協会(PHS)は、ワクチンの保存剤であるチメロサールを、出来得る限り早く、小児用に用いられるワクチンから取り除くように共同声明を出した7)。ワクチンからチメロサールを取り除く理由としては、予防接種に限らず水銀の曝露に対する大衆の関心が強く、避けることのできる曝露は避けたほうが良いと考えられるからである。アメリカでは2000年3月以降、チメロサールを保存剤として含まないB型肝炎ワクチンの接種を受けることが可能になった。Hib、DTaPにおいてもチメロサール無添加ワクチンがあり、無添加への移行が進んでいる。その結果、現在では、6ヶ月までの小児への予防接種スケジュール内での最大水銀曝露量は、約60%(187.5μg→75μg)減量された。しかしながら、世界的には多くの地域(特に発展途上国)で、費用や製造、保存場所などの理由で1つのバイアルを複数回使用するワクチンを製造せざるを得ない状況が続いている。そのような状況下では保存剤の添加は必要であり、チメロサールに代わる保存剤が必要となっている。WHOでも、先に1999年に示されたAAPとPHSの共同声明を支持し、ヨーロッパにおいても同様の勧告が出されている。その一方で、WHOのワクチン安全性委員会は、ワクチンを使用しなかった時のワクチンで予防できる病気による罹患・死亡・合併症といったリスク、あるいはチメロサール無添加の際にワクチンの病原体汚染による感染症のリスクは、ワクチン中のチメロサールによる副作用の可能性のあるリスクより、遙かに大きいと考えられるとしている。
6. 日本における最近の動向
日本においても、アメリカ合衆国、欧州、WHOと同じく、チメロサールをワクチンにできるだけ添加しない方向にあり、ワクチン中のチメロサールの減量や無添加が見られている。1999年9月には厚生省医薬品安全局より、ワクチン類の製造工程でのチメロサールの使用を縮小するよう通知が出された。表3は現在日本で販売されているワクチンの中のチメロサール含有量をまとめたものである。三種混合の予防接種は、日本で唯一、生後6ヶ月以内に注射されるワクチンであり、初回免疫成立のために3回、それぞれ3~8週間の間隔で、さらに、追加免疫のために、6ヶ月以上間隔をあけて1回接種される。(生後6ヶ月に限れば、平均的には3回のことが多い)。この表では三種混合のワクチン中のチメロサール含有量は最大で、0.05mg/0.5mlであるが、一般的には0.005mg/0.5mlのものを使用することが多い。一回あたり注射される量が約0.5mlであるから、三種混合を三回受けると0.015mgのチメロサールを摂取されること(水銀量はさらにその約半量の0.0075mg)になる。これはアメリカで生後六ヶ月以内に接種される量(1999年当時)の約1/20であり、EPAのメチル水銀のRfDより計算した累積限界曝露量(表1)の1/10以下である。日本においては、さらにチメロサールの減量化、チメロサール無添加化が進められており、現在、ワクチンにより曝露されるチメロサール量は極めて少ないと考えることができる。
7. まとめ
以上のことをまとめると、各国の関係機関とWHOは、ワクチン中のチメロサール量を減らすことを勧めてはいるが、アメリカにおいてワクチンによる健康の被害がチメロサールによるものであるというはっきりとした証拠はこれまで報告されていなかった8)。一方、最近、乳幼児へのチメロサール使用のワクチン接種と自閉症などとの関連を示唆する研究も報告された9)。これはCDCのワクチンデータベース情報等を基に行われた調査であり、集団を特定して計画されたコホート研究ではなく、他の交絡要因との検討等はなされていないなどまだ不充分なところがある。日本においては、生後六ヶ月未満に限るとワクチンによる水銀曝露量がアメリカと比べ極めて少ないことを考えると乳幼児へ影響は少ないと思われる。しかし、その健康影響の詳細がまだ完全に明らかとはなっていないことから、さらにチメロサール減量化およびチメロサールフリーのワクチンの使用を進めていくのが、より望ましいであろう。世界的には、ワクチン中のチメロサールの使用の有無はリスクとベネフィットの良いバランスの上に考える必要があり、ワクチンを接種されないための病気の罹患のリスク、多人数用のワクチンでのチメロサールを使用しない場合の感染のリスク、代替保存剤の毒性リスクなども考慮し、慎重に進めていく必要があるであろう。また、今後、遺伝素因の違いによる影響の個人差などのより一層詳細な情報のための基礎研究の進展が望まれる。
参考文献
- Bernard, S., et.al: Autism: a novel form of mercury poisoning, Medical Hypotheses 56(4): 462-471, 2001 http://www.ncbi.nlm.nih.gov/pubmed/11339848
- http://www.iom.edu/
- Lesilie K., et.al: An Assessment of Thimerosal Use in Childhood Vaccines: Pediatrics 107 (5): 1147-1154, 2001 http://www.ncbi.nlm.nih.gov/pubmed/11331700
- Recommended Childhood Immunization Schedule− United States, 2002. JAMA 287(6): 707-708, 2002 http://www.ncbi.nlm.nih.gov/pubmed/11855384
- Magos, L., et.al: The comparative toxicology of ethyl- and methylmercury. Archives of Toxicology 57. 260-267, 1985 http://www.ncbi.nlm.nih.gov/pubmed/4091651
- Brent, J.: Toxicologists and the Assessment of Risk: The Problem with Mercury (Commentary), Clinical Toxicology 39(7): 707-710, 2001 http://www.ncbi.nlm.nih.gov/pubmed/11778668
- 7) American Academy of Family Physicians: Thimerosal in Vaccines, http://www.aafp.org/x1566.xml
- Pichichero, M.E., et.al: Mercury concentrations and metabolism in infants receiving vaccines containing thiomersal: a descriptive study. Lancet 360. 1737-1741, 2002 http://www.ncbi.nlm.nih.gov/pubmed/12480426
- Geier, M. R., et.al: Thimerosal in Childhood Vaccines, Neurodevelopment Disorders, and Heart Disease in the United States. Journal of American Physicians and Surgeons 8(1). 6-11, 200
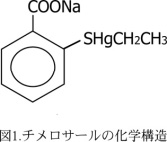
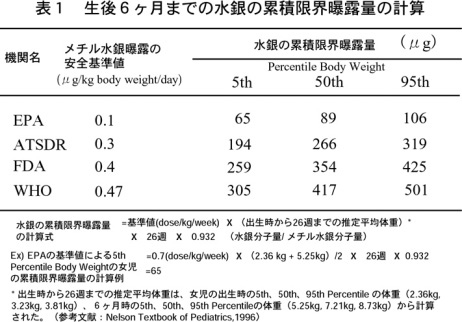
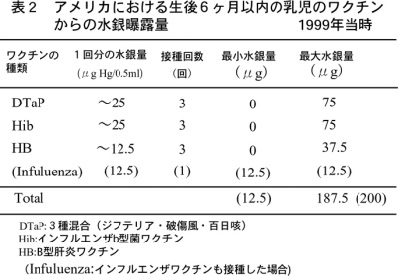
Ⅳ 考察
「国際的水銀汚染問題への対応に関する研究」
水俣病の発生以来、水銀による環境汚染に伴う健康被害は世界各国の大きな関心事になったが、近年懸念されているのは、金の採掘、精錬、取引に従事している作業者は、水銀蒸気に曝露され、更に金を抽出するときに使用される金属水銀が環境中に放出され、その地域のみならず河川を汚染することである。しかも、水中で無機水銀からメチル水銀への有機化が起こり、食物連鎖を通じて魚介類への蓄積が生じる。このメチル水銀による汚染が食糧源を魚介類に依存する河川流域の住民に対し健康被害をもたらすと懸念されている。金採掘地域の水銀汚染の問題は、アマゾン川流域が、古くから知られていたが、アフリカ、アジア、東欧の金産出国でも同様な問題を抱えている。世界中に小規模金採掘地が点在しており、金採掘に使用される水銀が人為的な環境汚染の発生源として注目されている。しかしながら金採掘に関連する水銀汚染の実態や健康影響に関する調査及び報告は充分とは言えない。
アマゾン川流域住民では、神経生理学的検査により軽度な健康影響が観察されたが、メチル水銀曝露によるものか明らかではなく、それは、この地域で昆虫を媒介としたマラリアがよく発生し、その駆除に使用される殺虫剤やマラリア治療薬が交絡因子となっているからである。アマゾン川流域の住民、とくに高濃度の水銀に汚染されていると思われる地域において、上記交絡因子の関係を明らかにするためにも新たな環境モニタリングや健康調査を早期に実施する必要がある。
アフリカでは、未だ調査データは極めて少なく、水銀汚染の程度そして汚染による生態系およびヒトへの影響に関する評価は不十分である。実際に、アフリカの多くの金産出国では、金採掘にともなう水銀汚染による生態系への影響が深刻であることは、ほとんど認識されていない。アフリカの水銀汚染問題およびその汚染が生態系とヒトに及ぼす健康影響を適切に評価するためも、国際的な共同調査が必要である。
CISおよび東欧の金生産国で昔から採掘している金採掘地域でも、世界の金採掘地と同様に水銀汚染の問題を抱えているが、水銀汚染に関する調査は費用が掛かるため行われておらず、多くの国では水銀汚染に対する解決の見通しは全くたっていない。金採掘地域における水銀放出発生源は、主に金鉱石を選鉱したのちに排出される大量の尾鉱堆積物であるが、これらから再び金を回収するために大量の水銀が使用されるため、水銀汚染は更に増大することになる。このように、シベリア、ウラル、極東における過去そして現在の金採掘地および居住地域の多くは水銀に汚染されている。水銀による環境汚染と健康影響を考える上で、様々な気候条件下での水銀のメチル化は重要な問題である。この点を明らかにするには広範囲に渡る現地調査が必要であり、加えて金採掘地域における環境改善のための各国政府等による予算の確保が強く求められている。
インドネシア国内での金採掘に伴う水銀の使用量の増加は、地域社会に対する水銀汚染の拡大をもたらし、このことがこの国の新たな病巣と成りつつある。それゆえ、緊急な水銀汚染の実態調査が必要である。さらにインドネシアが現在直面している水銀問題以外に、国際水域に対する海洋汚染の危険性についても考慮すべきである。またアジアの小規模金採掘地で金採掘を操業している国々では、健康、安全、環境、労働条件などの深刻な問題が報告されている。
以上のことから、小規模金採掘作業者の環境保全に対する意識の向上とそのための啓蒙活動が重要であると考えられる。水銀汚染は河川に留まらず、魚介類の水銀汚染を引き起こし、魚介類を食糧源とする河川流域住民にメチル水銀による健康被害をもたらすことがありえる。すでに住民の毛髪中水銀濃度が高いことから、早急な健康被害の把握とその予防対策を実施する必要性に迫られている。今後、世界各国に点在する小規模金採掘地域における水銀汚染の環境モニタリングの継続的な実施と金採掘作業者ならびに水銀アマルガムの加熱処理作業者の水銀蒸気よる健康被害および地域住民の健康被害の調査と実態把握が急務であろう。
「有機水銀の健康影響に関する研究のレビュー」
フェローおよびセイシェル出生コホート研究
母親の食事由来の低濃度メチル水銀の胎児期曝露が、その後の児の発達に与える影響を検証する疫学的調査として良く知られているのは、フェロー出生コホート研究(Faroese Birth Cohort Study)とセイシェル小児発達研究(Seychelles Child Development Study: SCDS)の2つのコホート研究である。フェロー出生コホート研究では7歳児において、いくつかの神経心理学的検査にて胎児期のメチル水銀曝露の影響と考えられる得点の低下が認められた。しかしながら、SCDSは対象集団の規模とメチル水銀の曝露量、および神経発達の検査法がフェロー出生コホート研究と比較的類似しているにも関わらず、結果的には認知行動への影響は見出されなかった。この理由としては曝露源の違い、PCB曝露の有無などが考えられている。フェロー出生コホート研究では、PCBの曝露影響を除外しても、なおメチル水銀曝露による運動機能および言語能力への影響が有意であることを証明した。
米国EPAがイラクのメチル水銀禍のデータを基に算出したメチル水銀摂取基準量(RfD)は、フェロー出生コホート研究の解析結果を用いて修正した現在も、0.1μg/kg 体重/日のままである。しかしながら、ヒトに有害影響の現れるメチル水銀の閾値レベルは、科学論文が発表される毎に、徐々に低下する傾向にある。2003年6月11~19日にローマで開催されたFAO/WHO合同食品添加物専門家委員会(JECFA)は、それまで3.3μg/kg 体重/週であった暫定的耐容週間摂取量(provisional tolerable weekly intake、PTWI)を、セイシェルとフェロー諸島の両研究データを用いて再計算し、1.6 μg/kg 体重/週とした。このようにメチル水銀曝露による健康影響に関する研究は、曝露指標とともに影響指標の吟味・見直しを経ながら、地道ではあるが着実な進歩を遂げているように思える。しかし、魚介類由来のメチル水銀曝露のゼロリスク指向は、ヒト乳幼児の神経発達に欠かせない長鎖不飽和脂肪酸の摂取制限等を含み、世界の食料問題全体の見直しを必要とするだろう。
実験動物におけるメチル水銀の健康影響・胎児期曝露影響
実験動物におけるメチル水銀の健康影響については、1997年以降に発表された論文を対象にレビューをしたが、それぞれの論文が興味深い知見を提供しているものの、完成度の高い論文は比較的少なかった。特にメチル水銀の胎児期曝露影響に関しては、もう少し大規模で組織的な研究が必要のように思われる。メチル水銀の健康影響について、様々な角度からの検討結果が報告されているが、さらなる進展を期待したい。
「その他、水銀含有物による健康影響」
歯科用アマルガムから発生される水銀蒸気曝露は、WHOの職業性水銀蒸気曝露の勧告限界値25μg/m3より低い濃度である。このような低濃度の長期間の水銀蒸気曝露による生殖器や胎児への影響については、ほとんど研究がなされていない。今後、低濃度曝露による水銀の胎盤透過、胎盤機能への影響、胎児毒性、および行動異常を含めた胎児の発達障害、変性疾患との関連性などが解明すべき問題となると考える。
各国の関係機関と WHOは、ワクチン中のチメロサール量を減らすことを勧めてはいるが、アメリカにおいてワクチンによる健康の被害がチメロサールによるものであるという証拠は今のところ無い。またワクチンを使用しなかった時のワクチンで予防できる病気による罹患・死亡・合併症といったリスクやチメロサールをワクチンに添加しない時の多人数用のワクチンが病原体で汚染した場合のワクチンによる感染症のリスクは、ワクチン中のチメロサールによる副作用が生じる可能性のリスクより、はるかに大きいと考えられる。したがって、発展途上国などにおいて防腐剤が必要不可欠な場合、チメロサールが含まれていることはやむを得ないだろう。日本においては、生後六ヶ月未満に限るとワクチンのチメロサール摂取量はアメリカより少ないため、ワクチン中のチメロサールによる被害はないか、または極めて少ないものと考えられる。
Ⅴ 結論
近年、世界各国に点在する小規模金採掘地域における金属水銀による環境汚染が問題となっている。環境中に放出された無機水銀は、環境中でメチル化され、食物連鎖を通じて魚介類へのメチル水銀の蓄積が生じ、それを食する河川流域住民の健康影響が懸念されている。小規模金採掘地域では、水銀汚染による生態系への影響が深刻であることは、ほとんど認識されていない。小規模金採掘作業者の環境保全に対する意識の向上とそのための啓蒙活動が重要であると考えられる。すでに住民の毛髪中水銀濃度が高いことから、今後、世界各国に点在する小規模金採掘地域における水銀汚染の環境モニタリングの継続的な実施と金採掘作業者のみならず地域住民の健康被害の早急な把握とその予防対策を実施することが急務であろう。これらを明らかにするには広範囲に渡る現地調査が必要であり、加えて金採掘地域における環境改善のための、各国政府等による予算の確保が強く求められる。また国際的水銀汚染問題およびその汚染が生態系とヒトの健康に及ぼす影響を適切に評価するためも、国際的な共同調査が必要であろう。
2003年6月にJECFAは、それまで3.3μg/kg 体重/週であった暫定的耐容週間摂取量(PTWI)を、セイシェルとフェロー諸島の両研究データを用いて再計算し、1.6μg/kg 体重/週とした。このようにメチル水銀曝露による健康影響に関する研究は、曝露指標とともに影響指標を見直しながら進歩を遂げているように思える。しかし、魚介類由来のメチル水銀曝露のゼロリスク指向は、ヒト乳幼児の神経発達に欠かせない長鎖不飽和脂肪酸の摂取が制限されてしまうこととなる。日本の食生活や、世界の食糧事情を考慮し、リスクベネフィットの考え方を前提として、不確実係数(uncertainty factor)の設定および、RfDの算出は、充分に考慮する必要がある。そのためには、メチル水銀の胎児期曝露の健康影響の動物実験による基礎的研究及び、ヒトの大規模コホート調査もまだ不十分であり、今後、リスク評価のための更なる基礎研究の充実が望まれる。これらをもとに、世界の食糧事情を考慮しながら、メチル水銀のリスク評価とリスク管理を適切に行っていく必要があると考えられる。
また、デンタルアマルガムによる水銀蒸気曝露やチメロサールのエチル水銀曝露に代表されるように、食糧以外の水銀曝露源も日常にあり、これらのような水銀曝露の危険性についても常に基礎的研究を踏まえながら、リスク評価・リスク管理を続けていく必要があるだろう。
研究発表
- 佐藤洋, 岡知子, 亀尾聡美, 仲井邦彦. 水銀と健康問題 -過去と現在-. 環境科学会誌 2004;17(3):(印刷中).
- 村田勝敬, 仲井邦彦, 佐藤洋. メチル水銀と健康問題 ~未来~. 環境科学会誌 2004; 17(3):(印刷中).
- 吉田稔, 赤木洋勝. 発展途上国における金採掘の環境汚染と環境保全. 環境科学会誌 2004;17(3):(印刷中).
- 村田勝敬, 嶽石美和子, 岩田豊人. フェロー諸島における水銀と健康の問題. 環境科学会誌2004; 17(3): (印刷中).
- 岡知子, 仲井邦彦, 亀尾聡美, 佐藤洋. セイシェル共和国における水銀と健康の問題. 環境科学会誌 2004; 17(3): (印刷中).
- 村田勝敬, 嶽石美和子, 佐藤洋. メチル水銀基準摂取量のゆくえ. 公衆衛生 2003; 67(7):531-530.
- 村田勝敬, 嶽石美和子. 胎児性メチル水銀曝露による小児神経発達影響 –Faroh 研究を中心に–. 日本衛生学雑誌 2002; 57(7): 564-570.
- 高橋好文, 吉田稔. 歯科用アマルガムに使用される水銀のヒト及び環境への影響(総説). 聖マリアンナ医科大学雑誌 2002; 30: 1-10.
- 亀尾聡美, 閑野将行, 孫英煥, 野田一樹, 山本康央, 仲井邦彦, 佐藤洋. ワクチンに含まれるチメロサールのリスク評価と今後の対応. 公衆衛生 2004;(投稿済).
別表-1 水銀汚染に関連する論文1
mercury & pollution
- J. G. Arnason and B. A. Fletcher. A 40+ year record of Cd, Hg, Pb, and U deposition in sediments of Patroon Reservoir, Albany County, NY, USA,Environmental Pollution. 2003; 123: 383-91 http://www.ncbi.nlm.nih.gov/pubmed/12667766
- M. V. Balarama Krishna, D. Karunasagar and J. Arunachalam. Study of mercury pollution near a thermometer factory using lichens and mosses,Environmental Pollution. 2003; 124: 357-60 http://www.ncbi.nlm.nih.gov/pubmed/12758016
- R. Bindler. Estimating the natural background atmospheric deposition rate of mercury utilizing ombrotrophic bogs in southern Sweden, Environmental Science & Technology. 2003; 37: 40-6 http://www.ncbi.nlm.nih.gov/pubmed/12542288
- S. Bose-O'Reilly, G. Drasch, C. Beinhoff, S. Maydl, M. R. Vosko, G. Roider and D. Dzaja. The Mt. Diwata study on the Philippines 2000-treatment of mercury intoxicated inhabitants of a gold mining area with DMPS (2,3-dimercapto-1-propane-sulfonic acid, Dimaval),Science of the Total Environment. 2003; 307: 71-82 http://www.ncbi.nlm.nih.gov/pubmed/12711426
- J. Bosnir, D. Puntaric, I. Skes, M. Klaric, S. Simic, I. Zoric and R. Galic. Toxic metals in freshwater fish from the Zagreb area as indicators of environmental pollution,Collegium Antropologicum. 2003; 27: 31-9 http://www.ncbi.nlm.nih.gov/pubmed/12955889
- C. Burbure, J. P. Buchet, A. Bernard, A. Leroyer, C. Nisse, J. M. Haguenoer, E. Bergamaschi and A. Mutti. Biomarkers of renal effects in children and adults with low environmental exposure to heavy metals, Journal of Toxicology & Environmental Health Part A. 2003; 66: 783-98 http://www.ncbi.nlm.nih.gov/pubmed/12746126
- J. De, N. Ramaiah, A. Mesquita and X. N. Verlekar. Tolerance to various toxicants by marine bacteria highly resistant to mercury, Marine Biotechnology. 2003; 5: 185-93 http://www.ncbi.nlm.nih.gov/pubmed/12876655
- L. Ferrat, M. Gnassia-Barelli, C. Pergent-Martini and M. Romeo. Mercury and non-protein thiol compounds in the seagrass Posidonia oceanica, Comparative Biochemistry & Physiology. Toxicology & Pharmacology: Cbp. 2003; 134: 147-55 http://www.ncbi.nlm.nih.gov/pubmed/12524027
- E. Fleit and G. Lakatos. Accumulative heavy metal patterns in the sediment and biotic compartments of the Tisza watershed, Toxicology Letters. 2003; 140-141: 323-32 http://www.ncbi.nlm.nih.gov/pubmed/12676481
- N. H. Golden and B. A. Rattner. Ranking terrestrial vertebrate species for utility in biomonitoring and vulnerability to environmental contaminants, Reviews of Environmental Contamination & Toxicology. 2003; 176: 67-136 http://www.ncbi.nlm.nih.gov/pubmed/12442504
- M. Horvat, N. Nolde, V. Fajon, V. Jereb, M. Logar, S. Lojen, R. Jacimovic, I. Falnoga, Q. Liya, J. Faganeli and D. Drobne. Total mercury, methylmercury and selenium in mercury polluted areas in the province Guizhou, China,Science of the Total Environment. 2003; 304: 231-56 http://www.ncbi.nlm.nih.gov/pubmed/12663187
- L. D. Hylander, H. Sollenberg and H. Westas. A three-stage system to remove mercury and dioxins in flue gases, Science of the Total Environment. 2003; 304: 137-44 http://www.ncbi.nlm.nih.gov/pubmed/12663178
- J. Loredo, A. Pereira and A. Ordonez. Untreated abandoned mercury mining works in a scenic area of Asturias (Spain),Environment International. 2003; 29: 481-91 http://www.ncbi.nlm.nih.gov/pubmed/12705946
- T. Matsuo. Japanese experiences of environmental management,Water Science & Technology. 2003; 47: 7-14 http://www.ncbi.nlm.nih.gov/pubmed/12578167
- M. Meili, K. Bishop, L. Bringmark, K. Johansson, J. Munthe, H. Sverdrup and W. de Vries. Critical levels of atmospheric pollution: criteria and concepts for operational modelling of mercury in forest and lake ecosystems,Science of the Total Environment. 2003; 304: 83-106 http://www.ncbi.nlm.nih.gov/pubmed/12663174
- A. Melamed. Environmental accountability in perioperative settings,AORN Journal. 2003; 77: 1157-68 http://www.ncbi.nlm.nih.gov/pubmed/12817740
- N. Mirlean, V. E. Andrus and P. Baisch. Mercury pollution sources in sediments of Patos Lagoon Estuary, Southern Brazil,Marine Pollution Bulletin. 2003; 46: 331-4 http://www.ncbi.nlm.nih.gov/pubmed/12604067
- C. Monteiro-Neto, R. V. Itavo and L. E. Moraes. Concentrations of heavy metals in Sotalia fluviatilis (Cetacea: Delphinidae) off the coast of Ceara, northeast Brazil,Environmental Pollution. 2003; 123: 319-24 http://www.ncbi.nlm.nih.gov/pubmed/12628211
- N. Ramaiah and J. De . Unusual rise in mercury-resistant bacteria in coastal environs, Microbial Ecology. 2003; 45: 444-54 http://www.ncbi.nlm.nih.gov/pubmed/12704552
- S. Remy, P. Prudent, C. Hissler, J. L. Probst and G. Krempp. Total mercury concentrations in an industrialized catchment, the Thur River basin (north-eastern France): geochemical background level and contamination factors,Chemosphere. 2003; 52: 635-44 http://www.ncbi.nlm.nih.gov/pubmed/12738301
- H. Shaner and M. L. Botter. Pollution: health care's unintended legacy,AJN, American Journal of Nursing. 2003; 103: 79, 81, 83-4 http://www.ncbi.nlm.nih.gov/pubmed/12626947
- M. Stoltenberg, A. Larsen, K. Kemp, D. Bloch and P. Weihe. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands,International Journal of Circumpolar Health. 2003; 62: 182-9 http://www.ncbi.nlm.nih.gov/pubmed/12862181
- C. Walcek, S. De Santis and T. Gentile. Preparation of mercury emissions inventory for eastern North America, Environmental Pollution. 2003; 123: 375-81 http://www.ncbi.nlm.nih.gov/pubmed/12667765
- N. Yamaguchi, D. Gazzard, G. Scholey and D. W. Macdonald. Concentrations and hazard assessment of PCBs, organochlorine pesticides and mercury in fish species from the Upper Thames: river pollution and its potential effects on top predators,Chemosphere. 2003; 50: 265-73 http://www.ncbi.nlm.nih.gov/pubmed/12656245
- A. Anandraj, D. J. Marshall, M. A. Gregory and T. P. McClurg. Metal accumulation, filtration and O(2) uptake rates in the mussel Perna perna (Mollusca: Bivalvia) exposed to Hg(2+), Cu(2+) and Zn(2+),Comparative Biochemistry & Physiology. Toxicology & Pharmacology: Cbp. 2002; 132: 355-63
- M. Bake, B. V. Aulika and I. Luse. Risk vliianiia khimicheskogo faktora na zdorov'estomatologov, Gigiena i Sanitariia 2002; 29-30
- V. Besada, J. Fumega and A. Vaamonde. Temporal trends of Cd, Cu, Hg, Pb and Zn inmussel (Mytilus galloprovincialis) from the Spanish North-Atlantic coast 1991-1999,Science of the Total Environment. 2002; 288: 239-53 http://www.ncbi.nlm.nih.gov/pubmed/11991527
- P. T. Bolger and D. C. Szlag. An electrochemical system for removing and recovering elemental mercury from a gas stream.[comment],Environmental Science & Technology. 2002; 36: 4430-5 http://www.ncbi.nlm.nih.gov/pubmed/12387419
- J. Burger, C. Dixon, T. Shukla, N. Tsipoura and M. Gochfeld. Metal levels in horseshoe crabs (Limulus polyphemus) from Maine to Florida, Environmental Research. 2002; 90: 227-36 http://www.ncbi.nlm.nih.gov/pubmed/12477468
- J. A. Camargo. Contribution of Spanish-American silver mines (1570-1820) to the present high mercury concentrations in the global environment: a review,Chemosphere. 2002; 48: 51-7 http://www.ncbi.nlm.nih.gov/pubmed/12137057
- Y. de Lafontaine, N. L. Gilbert, F. Dumouchel, C. Brochu, S. Moore, E. Pelletier, P. Dumont and A. Branchaud. Is chemical contamination responsible for the decline of the copper redhorse (Moxostoma hubbsi), an endangered fish species, in Canada?,Science of the Total Environment. 2002; 298: 25-44 http://www.ncbi.nlm.nih.gov/pubmed/12449327
- A. Dommergue, C. P. Ferrari, F. A. Planchon and C. F. Boutron. Influence of anthropogenic sources on total gaseous mercury variability in Grenoble suburban air (France), Science of the Total Environment. 2002; 297: 203-13 http://www.ncbi.nlm.nih.gov/pubmed/12389792
- A. M. Essa, L. E. Macaskie and N. L. Brown. Mechanisms of mercury bioremediation, Biochemical Society Transactions. 2002; 30: 672-4 http://www.ncbi.nlm.nih.gov/pubmed/12196161
- J. Falandysz, L. Bielawski, K. Kannan, M. Gucia, K. Lipka and A. Brzostowski. Mercury in wild mushrooms and underlying soil substrate from the great lakes land in Poland,Journal of Environmental Monitoring. 2002; 4: 473-6 http://www.ncbi.nlm.nih.gov/pubmed/12195986
- C. Feiyan, S. O. Pehkonen and M. B. Ray. Kinetics and mechanisms of UV-photodegradation of chlorinated organics in the gas phase,Water Research. 2002; 36: 4203-14 http://www.ncbi.nlm.nih.gov/pubmed/12420925
- A. Furst. Can nutrition affect chemical toxicity?,International Journal of Toxicology. 2002; 21: 419-24 http://www.ncbi.nlm.nih.gov/pubmed/12396688
- M. A. Gregory, D. J. Marshall, R. C. George, A. Anandraj and T. P. McClurg. Correlations between metal uptake in the soft tissue of Perna perna and gill filament pathology after exposure to mercury,Marine Pollution Bulletin. 2002; 45: 114-25 http://www.ncbi.nlm.nih.gov/pubmed/12398375
- H. M. Guzman and E. M. Garcia. Mercury levels in coral reefs along the Caribbean coast of Central America, Marine Pollution Bulletin. 2002; 44: 1415-20 http://www.ncbi.nlm.nih.gov/pubmed/12523547
- D. J. Hoffman. Role of selenium toxicity and oxidative stress in aquatic birds,Aquatic Toxicology. 2002; 57: 11-26 http://www.ncbi.nlm.nih.gov/pubmed/11879935
- J. R. Ikingura and H. Akagi. Lichens as a good bioindicator of air pollution by mercury in small-scale gold mining areas, Tanzania, Bulletin of Environmental Contamination & Toxicology. 2002; 68: 699-704 http://www.ncbi.nlm.nih.gov/pubmed/12068936
- S. Jahanbakht, F. Livardjani and A. Jaeger. An experimental ecotoxicological study and its application to the behavioural study of organic mercury (CH3HgCl) in the environment: influence of temperature and pH,Chemosphere. 2002; 49: 1399-405 http://www.ncbi.nlm.nih.gov/pubmed/12489737
- E. Janssens, T. Dauwe, L. Bervoets and M. Eens. Inter- and intraclutch variability in heavy metals in feathers of great tit nestlings ( Parus major) along a pollution gradient,Archives of Environmental Contamination & Toxicology. 2002; 43: 323-9 http://www.ncbi.nlm.nih.gov/pubmed/12202929
- "N. R. Khatlwada, S. Takizawa, T. V. Tran and M. Inoue. Groundwater contamination assessment for sustainable water supply in Kathmandu Valley, Nepal,Water Science & Technology. 2002; 46: 147-54" http://www.ncbi.nlm.nih.gov/pubmed/12448463
- "A. Kostamo, H. Hyvarinen, J. Pellinen and J. V. Kukkonen. Organochlorine concentrations in the Saimaa ringed seal (Phoca hispida saimensis) from Lake Haukivesi, Finland, 1981 to 2000, and in its diet today, Environmental Toxicology & Chemistry. 2002; 21: 1368-76" http://www.ncbi.nlm.nih.gov/pubmed/12109735
- "Z. Kwokal, S. Franciskovic-Bilinski, H. Bilinski and M. Branica. A comparison of anthropogenic mercury pollution in Kastela Bay (Croatia) with pristine estuaries in Ore (Sweden) and Krka (Croatia),Marine Pollution Bulletin. 2002; 44: 1152-7" http://www.ncbi.nlm.nih.gov/pubmed/12474978
- "T. K. Larionova. Professional'naia i ekologicheskaia komponenty regional'nogo tekhnogennogo riska zdorov'iu naseleniia pri vozde?stvii rtuti,Meditsina Truda i Promyshlennaia Ekologiia 2002; 33-7"
- "Y. Li, Y. Jiang, X. P. Yan and Z. M. Ni. Determination of trace mercury in environmental and foods samples by online coupling of flow injection displacement sorption preconcentration to electrothermal atomic absorption spectrometry,Environmental Science & Technology. 2002; 36: 4886-91" http://www.ncbi.nlm.nih.gov/pubmed/12487313
- "M. Mwase, B. Almli, T. Sivertsen, M. M. Musonda and A. Flaoyen. Hepatic and renal concentrations of copper and other trace elements in hippopotami (Hippopotamus amphibius L) living in and adjacent to the Kafue and Luangwa Rivers in Zambia, Onderstepoort Journal of Veterinary Research. 2002; 69: 207-14" http://www.ncbi.nlm.nih.gov/pubmed/12356167
- "R. Petkewich. Mercury pollution may contribute to antibiotic resistance, Environmental Science & Technology. 2002; 36: 310A-311A" http://www.ncbi.nlm.nih.gov/pubmed/12188337
- "E. K. Silbergeld, D. Nash, C. Trevant, G. T. Strickland, J. M. de Souza and R. S. da Silva. Mercury exposure and malaria prevalence among gold miners in Para, Brazil, Revista Da Sociedade Brasileira de Medicina Tropical. 2002; 35: 421-9" http://www.ncbi.nlm.nih.gov/pubmed/12621659
- "M. Q. Zhang, Y. C. Zhu and R. W. Deng. Evaluation of mercury emissions to the atmosphere from coal combustion, China,Ambio. 2002; 31: 482-4" http://www.ncbi.nlm.nih.gov/pubmed/12436847
- "R. Arvizu-Torres, A. Perez-Castorena, J. A. Salas-Tellez and Y. Mitani-Nakanishi. Biological and environmental reference materials in CENAM, Fresenius Journal of Analytical Chemistry. 2001; 370: 156-9" http://www.ncbi.nlm.nih.gov/pubmed/11451228
- "S. B. De Luca-Abbott, B. S. Wong, D. B. Peakall, P. K. Lam, L. Young, M. H. Lam and B. J. Richardson. Review of effects of water pollution on the breeding success of waterbirds, with particular reference to ardeids in Hong Kong, Ecotoxicology. 2001; 10: 327-49" http://www.ncbi.nlm.nih.gov/pubmed/11759567
- "N. V. Efimova and V. S. Rukavishnikov. Mediko-ekologicheskaia otsenka rtutno? opasnosti dlia naseleniia Irkutsko? oblasti, Gigiena i Sanitariia 2001; 19-21"
- "E. Janssens, T. Dauwe, L. Bervoets and M. Eens. Heavy metals and selenium in feathers of great tits (Parus major) along a pollution gradient, Environmental Toxicology & Chemistry. 2001; 20: 2815-20" http://www.ncbi.nlm.nih.gov/pubmed/11764165
- "R. M. Raina, P. Pawar and R. N. Sharma Developmental inhibition and reproductive potential impairment in Musca domestica L. by heavy metals, Indian Journal of Experimental Biology. 2001; 39: 78-81" http://www.ncbi.nlm.nih.gov/pubmed/11349532
- "A. Roos, E. Greyerz, M. Olsson and F. Sandegren The otter (Lutra lutra) in Sweden--population trends in relation to sigma DDT and total PCB concentrations during 1968-99. [erratum appears in Environ Pollut 2001;112(3):521],Environmental Pollution. 2001; 111: 457-69" http://www.ncbi.nlm.nih.gov/pubmed/11202751
- "T. H. Wakeman and N. J. Themelis A basin-wide approach to dredged material management in New York/New Jersey Harbor, Journal of Hazardous Materials. 2001; 85: 1-13" http://www.ncbi.nlm.nih.gov/pubmed/11463500
- "M. J. Carvan, 3rd, T. P. Dalton, G. W. Stuart and D. W. Nebert Transgenic zebrafish as sentinels for aquatic pollution, Annals of the New York Academy of Sciences. 2000; 919: 133-47" http://www.ncbi.nlm.nih.gov/pubmed/11083105
- "T. K. Larionova. Rtut' v organizme liude? v usloviiakh zagriazneniia okruzhaiushche? sredy rtut'soderzhashchimi promyshlennymi otkhodami,Gigiena i Sanitariia 2000; 8-10"
- "O. Simsek, R. Gultekin, O. Oksuz and S. Kurultay. The effect of environmental pollution on the heavy metal content of raw milk, Nahrung. 2000; 44: 360-3" http://www.ncbi.nlm.nih.gov/pubmed/11075380
- "A. Affelska-Jercha. Toksyczne dzia?anie rteci w narazeniu zawodowym i ?rodowiskowym, Medycyna Pracy 1999; 50: 305-14" http://www.ncbi.nlm.nih.gov/pubmed/10582209
- "B. Albiger, J. C. Hubert and M. C. Lett. Identification of the plasmid-mobilization potential of the strain Klebsiella pneumoniae ozenae KIIIA isolated from a polluted aquatic environment, Plasmid. 1999; 41: 30-9" http://www.ncbi.nlm.nih.gov/pubmed/9887304
- "S. P. Bizily, C. L. Rugh, A. O. Summers and R. B. Meagher. Phytoremediation of methylmercury pollution: merB expression in Arabidopsis thaliana confers resistance to organomercurials,Proceedings of the National Academy of Sciences of the United States of America. 1999; 96: 6808-13" http://www.ncbi.nlm.nih.gov/pubmed/10359794
- "M. Horvat, S. Covelli, J. Faganeli, M. Logar, V. Mandi, R. Rajar, A. Sirca and D. Zagar. Mercury in contaminated coastal environments; a case study: the Gulf of Trieste, Science of the Total Environment 1999; 237-238: 43-56" http://www.ncbi.nlm.nih.gov/pubmed/10568264
- "D. Michelot, F. Poirier and L. M. Melendez-Howell. Metal content profiles in mushrooms collected in primary forests of Latin America, Archives of Environmental Contamination & Toxicology. 1999; 36: 256-63" http://www.ncbi.nlm.nih.gov/pubmed/10047592
- "A. J. Ghio, J. H. Richards, K. L. Dittrich and J. M. Samet. Metal storage and transport proteins increase after exposure of the rat lung to an air pollution particle, Toxicologic Pathology. 1998; 26: 388-94" http://www.ncbi.nlm.nih.gov/pubmed/9608645
- "O. A. Ogunseitan. Protein method for investigating mercuric reductase gene expression in aquatic environments, Applied & Environmental Microbiology. 1998; 64: 695-702" http://www.ncbi.nlm.nih.gov/pubmed/9464410
- "E. C. Parsons. Trace metal pollution in Hong Kong: implications for the health of Hong Kong's Indo-Pacific hump-backed dolphins (Sousa chinensis), Science of the Total Environment. 1998; 214: 175-84" http://www.ncbi.nlm.nih.gov/pubmed/9646525
- "C. L. Rugh, J. F. Senecoff, R. B. Meagher and S. A. Merkle. Development of transgenic yellow poplar for mercury phytoremediation. [comment], Nature Biotechnology. 1998; 16: 925-8" http://www.ncbi.nlm.nih.gov/pubmed/9788347
- "M. Gochfeld. Spatial patterns in a bioindicator: heavy metal and selenium concentration in eggs of herring gulls (Larus argentatus) in the New York Bight,Archives of Environmental Contamination & Toxicology. 1997; 33: 63-70" http://www.ncbi.nlm.nih.gov/pubmed/9216872
別表-2 水銀汚染に関連する論文2
mercury & fetus/infant(s)
- Anonymous. Mercury in vaccines may not pose harm, Child Health Alert. 2003; 21: 1 http://www.ncbi.nlm.nih.gov/pubmed/12608349
- "B. J. Biroscak, A. E. Fiore, N. Fasano, P. Fineis, M. P. Collins and G. Stoltman.Impact of the thimerosal controversy on hepatitis B vaccine coverage of infants born to women of unknown hepatitis B surface antigen status in Michigan, Pediatrics. 2003; 111: e645-9" http://www.ncbi.nlm.nih.gov/pubmed/12777580
- "A. F. Castoldi, T. Coccini and L. Manzo. Neurotoxic and molecular effects of methylmercury in humans, Reviews on Environmental Health. 2003; 18: 19-31" http://www.ncbi.nlm.nih.gov/pubmed/12875509
- "E. Colman Mercury in infants given vaccines containing thiomersal.[comment],Lancet. 2003; 361: 698; author reply 699" http://www.ncbi.nlm.nih.gov/pubmed/12606188
- "K. V. Gopal Neurotoxic effects of mercury on auditory cortex networks growing on microelectrode arrays: a preliminary analysis, Neurotoxicology & Teratology. 2003; 25: 69-76" http://www.ncbi.nlm.nih.gov/pubmed/12633738
- "P. Grandjean, E. Budtz-Jorgensen, U. Steuerwald, B. Heinzow, L. L. Needham, P. J. Jorgensen and P. Weihe Attenuated growth of breast-fed children exposed to increased concentrations of methylmercury and polychlorinated biphenyls,FASEB Journal. 2003; 17: 699-701" http://www.ncbi.nlm.nih.gov/pubmed/12586743
- "P. Grandjean, R. F. White, P. Weihe and P. J. Jorgensen. Neurotoxic risk caused by stable and variable exposure to methylmercury from seafood, Ambulatory Pediatrics. 2003; 3: 18-23" http://www.ncbi.nlm.nih.gov/pubmed/12540249
- "N. A. Halsey and L. R. Goldman. Mercury in infants given vaccines containing thiomersal. [comment],Lancet. 2003; 361: 698-9; author reply 699" http://www.ncbi.nlm.nih.gov/pubmed/12606189
- "J. M. Hightower and D. Moore. Mercury levels in high-end consumers of fish.[comment],Environmental Health Perspectives. 2003; 111: 604-8" http://www.ncbi.nlm.nih.gov/pubmed/12676623
- "H. L. Jones, C. B. Kleber, G. J. Eckert and B. E. Mahon. Comparison of rectal temperature measured by digital vs. mercury glass thermometer in infants under two months old, Clinical Pediatrics. 2003; 42: 357-9" http://www.ncbi.nlm.nih.gov/pubmed/12800731
- "C. Karsli, E. Wilson-Smith, I. Luginbuehl and B. Bissonnette. The effect of nitrous oxide on cerebrovascular reactivity to carbon dioxide in children during propofol anesthesia, Anesthesia & Analgesia. 2003; 97: 694-8" http://www.ncbi.nlm.nih.gov/pubmed/12933387
- "P. O. Ozuah, M. S. Lesser, J. S. Woods, H. Choi and M. Markowitz. Mercury exposure in an urban pediatric population, Ambulatory Pediatrics. 2003; 3: 24-6" http://www.ncbi.nlm.nih.gov/pubmed/12540250
- "G. B. Ramirez, O. Pagulayan, H. Akagi, A. Francisco Rivera, L. V. Lee, A. Berroya, M. C. Vince Cruz and D. Casintahan. Tagum study II: follow-up study at two years of age after prenatal exposure to mercury, Pediatrics. 2003; 111: e289-95" http://www.ncbi.nlm.nih.gov/pubmed/12612286
- "S. E. Schober, T. H. Sinks, R. L. Jones, P. M. Bolger, M. McDowell, J. Osterloh, E. S. Garrett, R. A. Canady, C. F. Dillon, Y. Sun, C. B. Joseph and K. R. Mahaffey. Blood mercury levels in US children and women of childbearing age, 1999-2000, Jama. 2003; 289: 1667-74" http://www.ncbi.nlm.nih.gov/pubmed/12672735
- "M. Weinstein and S. Bernstein. Pink ladies: mercury poisoning in twin girls. [erratum appears in CMAJ. 2003 Feb 18;168(4):400],CMAJ Canadian Medical Association Journal. 2003; 168: 201" http://www.ncbi.nlm.nih.gov/pubmed/12538551
- "G. Westphal and E. Hallier. Mercury in infants given vaccines containing thiomersal.[comment], Lancet. 2003; 361: 699; author reply 699" http://www.ncbi.nlm.nih.gov/pubmed/12606190
- "M. Aschner and S. J. Walker. The neuropathogenesis of mercury toxicity, Molecular Psychiatry. 2002; 7: S40-1" http://www.ncbi.nlm.nih.gov/pubmed/12142946
- "S. Bernard, A. Enayati, H. Roger, T. Binstock and L. Redwood. The role of mercury in the pathogenesis of autism, Molecular Psychiatry. 2002; 7: S42-3" http://www.ncbi.nlm.nih.gov/pubmed/12142947
- "A. T. Borchers, C. L. Keen, Y. Shoenfeld, J. Silva, Jr. and M. E. Gershwin. Vaccines, viruses, and voodoo, Journal of Investigational Allergology & Clinical Immunology. 2002; 12: 155-68" http://www.ncbi.nlm.nih.gov/pubmed/12530114
- "J. A. Clark, M. W. Lieh-Lai, A. Sarnaik and T. K. Mattoo. Discrepancies between direct and indirect blood pressure measurements using various recommendations for arm cuff selection, Pediatrics. 2002; 110: 920-3" http://www.ncbi.nlm.nih.gov/pubmed/12415030
- "J. V. Craig, G. A. Lancaster, S. Taylor, P. R. Williamson and R. L. Smyth. Infrared ear thermometry compared with rectal thermometry in children: a systematic review. [comment], Lancet. 2002; 360: 603-9" http://www.ncbi.nlm.nih.gov/pubmed/12241932
- "M. O. Enrique, V. Morales, E. Ngoumgna, R. Prescilla, E. Tan, E. Hernandez, G. B. Ramirez, H. L. Cifra and M. L. Manlapaz. Prevalence of fetal exposure to environmental toxins as determined by meconium analysis, Neurotoxicology. 2002; 23: 329-39" http://www.ncbi.nlm.nih.gov/pubmed/12389578
- "A. Gothberg, M. Greger and B. E. Bengtsson. Accumulation of heavy metals in water spinach (Ipomoea aquatica) cultivated in the Bangkok region, Thailand, Environmental Toxicology & Chemistry 2002; 21: 1934-9" http://www.ncbi.nlm.nih.gov/pubmed/12206434
- "C. Gundacker, B. Pietschnig, K. J. Wittmann, A. Lischka, H. Salzer, L. Hohenauer and E. Schuster. Lead and mercury in breast milk, Pediatrics 2002; 110: 873-8" http://www.ncbi.nlm.nih.gov/pubmed/12415023
- D. C. Henderson Mercury in vaccines--reassuring news. [comment], Lancet. 2002; 360:1711-2 http://www.ncbi.nlm.nih.gov/pubmed/12480419
- "D. C. Henderson Mercury in vaccines--reassuring news. [comment][erratum appears in Lancet. 2003 Feb 15;361(9357):616.], Lancet. 2002; 360: 1711-2" http://www.ncbi.nlm.nih.gov/pubmed/12480419
- "A. Kakita, C. Inenaga, M. Sakamoto and H. Takahashi Neuronal migration disturbance and consequent cytoarchitecture in the cerebral cortex following transplacental administration of methylmercury,Acta Neuropathologica. 2002; 104: 409-17" http://www.ncbi.nlm.nih.gov/pubmed/12200629
- "G. Kazantzis Mercury exposure and early effects: an overview, Medicina del Lavoro. 2002; 93: 139-47" http://www.ncbi.nlm.nih.gov/pubmed/12197264
- "T. A. Lewandowski, C. H. Pierce, S. D. Pingree, S. Hong and E. M. Faustman Methylmercury distribution in the pregnant rat and embryo during early midbrain organogenesis, Teratology. 2002; 66: 235-41" http://www.ncbi.nlm.nih.gov/pubmed/12397631
- "M. C. Nascimento, C. C. Xavier and E. M. Goulart. Arterial blood pressure of term newborns during the first week of life, Brazilian Journal of Medical & Biological Research 2002; 35: 905-11" http://www.ncbi.nlm.nih.gov/pubmed/12185382
- "M. E. Pichichero, E. Cernichiari, J. Lopreiato and J. Treanor. Mercury concentrations and metabolism in infants receiving vaccines containing thiomersal: a descriptive study. [comment], Lancet. 2002; 360: 1737-41" http://www.ncbi.nlm.nih.gov/pubmed/12480426
- "T. G. Pickering. Principles and techniques of blood pressure measurement, Cardiology Clinics. 2002; 20: 207-23" http://www.ncbi.nlm.nih.gov/pubmed/12119797
- "M. Sakamoto, A. Kakita, K. Wakabayashi, H. Takahashi, A. Nakano and H. Akagi. Evaluation of changes in methylmercury accumulation in the developing rat brain and its effects: a study with consecutive and moderate dose exposure throughout gestation and lactation periods, Brain Research. 2002; 949: 51-9" http://www.ncbi.nlm.nih.gov/pubmed/12213299
- "E. C. Santos, V. M. Camara, I. M. Jesus, E. S. Brabo, E. C. Loureiro, A. F. Mascarenhas, K. F. Fayal, G. C. Sa Filho, F. E. Sagica, M. O. Lima, H. Higuchi and I. M. Silveira. A contribution to the establishment of reference values for total mercury levels in hair and fish in amazonia, Environmental Research. 2002; 90: 6-11" http://www.ncbi.nlm.nih.gov/pubmed/12359185
- "E. C. Santos, I. M. de Jesus, M. Camara Vde, E. Brabo, E. C. Loureiro, A. Mascarenhas, J. Weirich, R. R. Luiz and D. Cleary. Mercury exposure in Munduruku Indians from the community of Sai Cinza, State of Para, Brazil,Environmental Research. 2002; 90: 98-103" http://www.ncbi.nlm.nih.gov/pubmed/12483799
- "G. A. Wiesmuller, M. Weishoff-Houben, O. Brolsch, W. Dott and R. Schulze-Robbecke. Environmental agents as cause of health disorders in children presented at an outpatient unit of environmental medicine, International Journal of Hygiene & Environmental Health. 2002; 205: 329-35" http://www.ncbi.nlm.nih.gov/pubmed/12173530
- "M. Yoshida. Placental to fetal transfer of mercury and fetotoxicity, Tohoku Journal of Experimental Medicine. 2002; 196: 79-88" http://www.ncbi.nlm.nih.gov/pubmed/12498319
- "J. Bailey and P. Rose. Axillary and tympanic membrane temperature recording in the preterm neonate: a comparative study, Journal of Advanced Nursing 2001; 34: 465-74" http://www.ncbi.nlm.nih.gov/pubmed/11380713
- "L. K. Ball, R. Ball and R. D. Pratt. An assessment of thimerosal use in childhood vaccines. [comment],Pediatrics. 2001; 107: 1147-54" http://www.ncbi.nlm.nih.gov/pubmed/11331700
- "S. J. Clark, M. D. Cabana, T. Malik, H. Yusuf and G. L. Freed. Hepatitis B vaccination practices in hospital newborn nurseries before and after changes in vaccination recommendations,Archives of Pediatrics & Adolescent Medicine 2001; 155: 915-20" http://www.ncbi.nlm.nih.gov/pubmed/11483119
- "S. Dollberg, S. Lahav and F. B. Mimouni. Precision of a new thermometer for rapid rectal temperature measurement in neonates, American Journal of Perinatology 2001; 18: 103-5" http://www.ncbi.nlm.nih.gov/pubmed/11383699
- "P. Grandjean, K. S. Bjerve, P. Weihe and U. Steuerwald. Birthweight in a fishing community: significance of essential fatty acids and marine food contaminants. [comment], International Journal of Epidemiology 2001; 30: 1272-8" http://www.ncbi.nlm.nih.gov/pubmed/11821327
- "P. Grandjean, P. Weihe, V. W. Burse, L. L. Needham, E. Storr-Hansen, B. Heinzow, F. Debes, K. Murata, H. Simonsen, P. Ellefsen, E. Budtz-Jorgensen, N. Keiding and R. F. White. Neurobehavioral deficits associated with PCB in 7-year-old children prenatally exposed to seafood neurotoxicants, Neurotoxicology & Teratology 2001; 23: 305-17" http://www.ncbi.nlm.nih.gov/pubmed/11485834
- "N. A. Halsey and L. Goldman. Balancing risks and benefits: Primum non nocere is too simplistic.[comment],Pediatrics 2001; 108: 466-7" http://www.ncbi.nlm.nih.gov/pubmed/11483816
- "O. Mayer, Jr., H. Rosolova, M. Wiendl and J. Simon. Zm?ny rizikoveho profilu a vyvoj hypertenze v plzenske populaci mezi lety 1987-1989 a 1995-1996,Vnitrni Lekarstvi 2001; 47: 454-9" http://www.ncbi.nlm.nih.gov/pubmed/11505716
- "G. Muckle, P. Ayotte, E. E. Dewailly, S. W. Jacobson and J. L. Jacobson. Prenatal exposure of the northern Quebec Inuit infants to environmental contaminants, Environmental Health Perspectives 2001; 109: 1291-9" http://www.ncbi.nlm.nih.gov/pubmed/11748038
- "E. Nagy. Gender-related differences in rectal temperature in human neonates, Early Human Development 2001; 64: 37-43" http://www.ncbi.nlm.nih.gov/pubmed/11408107
- "C. Watanabe. Selenium deficiency and brain functions: the significance for methylmercury toxicity, Nippon Eiseigaku Zasshi - Japanese Journal of Hygiene 2001; 55: 581-9" http://www.ncbi.nlm.nih.gov/pubmed/11265129
- "anonymous Update: expanded availability of thimerosal preservative-free hepatitis B vaccine, MMWR - Morbidity & Mortality Weekly Report 2000; 49: 642" http://www.ncbi.nlm.nih.gov/pubmed/10926308
- "M. E. Barker, A. W. Shiell and C. M. Law. Evaluation of the Dinamap 8100 and Omron M1 blood pressure monitors for use in children, Paediatric and Perinatal Epidemiology 2000; 14: 179-86" http://www.ncbi.nlm.nih.gov/pubmed/10791663
- "P. Bjerregaard and J. C. Hansen. Organochlorines and heavy metals in pregnant women from the Disko Bay area in Greenland, Science of the Total Environment 2000; 245: 195-202" http://www.ncbi.nlm.nih.gov/pubmed/10682367
- "L. W. Doyle, G. W. Ford, N. M. Davis and C. Callanan. Antenatal corticosteroid therapy and blood pressure at 14 years of age in preterm children.[comment],Clinical Science 2000; 98: 137-42" http://www.ncbi.nlm.nih.gov/pubmed/10657267
- "A. S. Hill, T. B. Kurkowski and J. Garcia. Oral support measures used in feeding the preterm infant, Nursing Research 2000; 49: 2-10" http://www.ncbi.nlm.nih.gov/pubmed/10667623
- "G. J. Myers and P. W. Davidson. Does methylmercury have a role in causing developmental disabilities in children?, Environmental Health Perspectives 2000; 108 Suppl 3: 413-20" http://www.ncbi.nlm.nih.gov/pubmed/10852838
- "R. Pless and J. F. Risher. Mercury, infant neurodevelopment, and vaccination. [comment],Journal of Pediatrics 2000; 136: 571-3" http://www.ncbi.nlm.nih.gov/pubmed/10802484
- "R. S. Porter and F. G. Wenger. Diagnosis and treatment of pediatric fever by caretakers, Journal of Emergency Medicine 2000; 19: 1-4" http://www.ncbi.nlm.nih.gov/pubmed/10863110
- "A. Sganga, R. Wallace, E. Kiehl, T. Irving and L. Witter. A comparison of four methods of normal newborn temperature measurement, MCN, American Journal of Maternal Child Nursing 2000; 25: 76-9" http://www.ncbi.nlm.nih.gov/pubmed/10748584
- "G. V. Stajich, G. P. Lopez, S. W. Harry and W. R. Sexson Iatrogenic exposure to mercury after hepatitis B vaccination in preterm infants. [comment],Journal of Pediatrics 2000; 136: 679-81" http://www.ncbi.nlm.nih.gov/pubmed/10802503
- "U. Steuerwald, P. Weihe, P. J. Jorgensen, K. Bjerve, J. Brock, B. Heinzow, E. Budtz-Jorgensen and P. Grandjean Maternal seafood diet, methylmercury exposure, and neonatal neurologic function.[comment], Journal of Pediatrics 2000; 136: 599-605" http://www.ncbi.nlm.nih.gov/pubmed/10802490
- "A. Wakhlu and A. K. Wakhlu. The management of exomphalos, Journal of Pediatric Surgery 2000; 35: 73-6" http://www.ncbi.nlm.nih.gov/pubmed/10646778
- "N. A. Halsey. Limiting infant exposure to thimerosal in vaccines and other sources of mercury. [comment],Jama. 1999; 282: 1763-6" http://www.ncbi.nlm.nih.gov/pubmed/10568650
- "J. H. Lee, H. S. Kang and J. Roh. Protective effects of garlic juice against embryotoxicity of methylmercuric chloride administered to pregnant Fischer 344 rats, Yonsei Medical Journal 1999; 40: 483-9" http://www.ncbi.nlm.nih.gov/pubmed/10565261
- "J. L. Miller. Elimination of thimerosal from vaccines set as goal, American Journal of Health-System Pharmacy. 1999; 56: 1589, 1593" http://www.ncbi.nlm.nih.gov/pubmed/10459378
- "J. O. Odland, E. Nieboer, N. Romanova, Y. Thomassen, J. Brox and E. Lund. Self-reported ethnic status of delivering women, newborn body mass index, blood or urine concentrations of toxic metals, and essential elements in sera of Norwegian and Russian Arctic populations, International Journal of Circumpolar Health 1999; 58: 4-13" http://www.ncbi.nlm.nih.gov/pubmed/10208065
- "M. I. Ubeda Sansano, J. Diez Domingo, C. Casani Martinez, T. Alvarez de Laviada Mulero and A. Ballester Sanz. Validacion del termometro timpanico en atencion primaria, Atencion Primaria 1999; 23: 91-6" http://www.ncbi.nlm.nih.gov/pubmed/10081173
- "J. Brasch, J. Geier and A. Schnuch. Differenzierte Kontaktallergenlisten dienen der Qualitatsverbesserung, Hautarzt 1998; 49: 184-91" http://www.ncbi.nlm.nih.gov/pubmed/9565785
- "L. Hagmar, G. Becher, A. Heikkila, O. Frankman, E. Dyremark, A. Schutz, U. G. Ahlborg and E. Dybing. Consumption of fatty fish from the Baltic Sea and PCB in whole venous blood, plasma and cord blood from delivering women in the Aland/Turku archipelago, Journal of Toxicology & Environmental Health Part A 1998; 53: 581-91" http://www.ncbi.nlm.nih.gov/pubmed/9572157
- J. Hoey and B. Postl. Determinants--and determination.[comment],Cmaj 1998; 158: 1467-8 http://www.ncbi.nlm.nih.gov/pubmed/9629110
- "H. A. Kehrig, O. Malm, H. Akagi, J. R. Guimaraes and J. P. Torres. Methylmercury in fish and hair samples from the Balbina Feservoir, Brazilian Amazon.[comment],Environmental Research. 1998; 77: 84-90" http://www.ncbi.nlm.nih.gov/pubmed/9600800
- "V. P. Klopov. Levels of heavy metals in women residing in the Russian Arctic, International Journal of Circumpolar Health 1998; 57 Suppl 1: 582-5" http://www.ncbi.nlm.nih.gov/pubmed/10093346
- "M. K. Leick-Rude and L. F. Bloom. A comparison of temperature-taking methods in neonates, Neonatal Network - Journal of Neonatal Nursing 1998; 17: 21-37" http://www.ncbi.nlm.nih.gov/pubmed/9791443
- "N. Manandhar, M. Ellis, D. S. Manandhar, D. Morley and L. C. A. M. de. Liquid crystal thermometry for the detection of neonatal hypothermia in Nepal, Journal of Tropical Pediatrics 1998; 44: 15-7" http://www.ncbi.nlm.nih.gov/pubmed/9538600
- "B. M. Manzini, G. Ferdani, V. Simonetti, M. Donini and S. Seidenari Contact sensitization in children. [comment], Pediatric Dermatology. 1998; 15: 12-7" http://www.ncbi.nlm.nih.gov/pubmed/9496796
- "M. A. Montoya-Cabrera, P. Escalante-Galindo and E. Flores-Alvarez. Estudio comparativo entre la termometria timpanica y la mercurial en ninos, Gaceta Medica de Mexico 1998; 134: 9-14" http://www.ncbi.nlm.nih.gov/pubmed/9658694
- "N. Azas, C. Di Giorgio, F. Delmas, M. Gasquet and P. Timon-David Leishmania infantum promastigotes: flow cytometry as a possible tool for assessing the effects of drugs on cellular functions, Experimental Parasitology 1997; 87: 1-7" http://www.ncbi.nlm.nih.gov/pubmed/9287952
- "R. V. Baht and G. G. Moy. Monitoring and assessment of dietary exposure to chemical contaminants, World Health Statistics Quarterly - Rapport Trimestriel de Statistiques Sanitaires Mondiales 1997; 50: 132-49" http://www.ncbi.nlm.nih.gov/pubmed/9282396
- "J. M. Draaisma, R. J. van Lemmen, A. A. de Jong and W. Doesburg. Temperatuurmeting bij kinderen: met de trommelvliesinfraroodmeter en de rectale kwikthermometer even goede resultaten op de spoedeisendehulpafdeling, Nederlands Tijdschrift voor Geneeskunde 1997; 141: 938-41" http://www.ncbi.nlm.nih.gov/pubmed/9340539
- "N. A. Elghany, W. Stopford, W. B. Bunn and L. E. Fleming. Occupational exposure to inorganic mercury vapour and reproductive outcomes. [comment],Occupational Medicine (Oxford) 1997; 47: 333-6" http://www.ncbi.nlm.nih.gov/pubmed/9327634
- "Y. Groeneveld and J. Stolk. Temperatuurmeting bij kinderen: met de trommelvliesinfraroodmeter en de rectale kwikthermometer even goede resultaten op de spoedeisendehulpafdeling, Nederlands Tijdschrift voor Geneeskunde 1997; 141: 1400" http://www.ncbi.nlm.nih.gov/pubmed/9380203
- "T. M. Kudukis, C. A. Manthous, G. A. Schmidt, J. B. Hall and M. E. Wylam. Inhaled helium-oxygen revisited: effect of inhaled helium-oxygen during the treatment of status asthmaticus in children.[comment],Journal of Pediatrics. 1997; 130: 217-24" http://www.ncbi.nlm.nih.gov/pubmed/9042123
- "M. D. Martin, B. J. Williams, J. D. Charleston and D. Oda. Spontaneous exfoliation of teeth following severe elemental mercury poisoning: case report and histological investigation for mechanism. [comment],Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, & Endodontics. 1997; 84: 495-501" http://www.ncbi.nlm.nih.gov/pubmed/9394381
別表-3 水銀汚染に関連する論文3(和文)
水銀&汚染
- 牛島佳代, 北野隆雄, 庄野昌博, 岡知子,二塚信. メチル水銀汚染地域住民の精神不安の構造(第2報). 日本衛生学雑誌 2003; 58: 191.
- 永沼章,黄基旭. 【重金属中毒学 消滅しない元素の毒科学】 メチル水銀の毒性発現機構. 医学のあゆみ 2002; 202: 895-898.
- 牛島佳代, 岡知子, 北野隆雄,二塚信. メチル水銀汚染地域住民の精神不安に関する研究. 日本衛生学雑誌 2002; 57: 129.
- 高岡滋. メチル水銀汚染地域の内科外来患者の自覚症状. 臨床神経学 2002; 42: 1409.
- 松本美由紀, 宮本清香,臼杵扶佐子. PGC モラール・スケールを用いた水俣病患者の主観的満足度についての検討. 総合リハビリテーション 2002; 30: 81-85.
- 土井陸雄,大野秀樹. 【環境汚染因子 生体影響とその評価法】 水銀汚染. 臨床化学 2002; 31: 139-146.
- 衞藤光明. 水俣病(メチル水銀中毒症)の病因について 最新の知見に基づいての考察. 最新医学 2002; 57: 2418-2423.
- 牛島佳代, 岡知子, 北野隆雄,二塚信. メチル水銀汚染地域住民の健康状態と生活状況. 日本衛生学雑誌 2001; 56: 280.
- 張瑞軍, 鹿島勇治, 松井三明, 岡部とし子,土井陸雄. 東京湾とその周辺海域における魚の水銀濃度. 日本衛生学雑誌 2001; 56: 492-499. http://www.ncbi.nlm.nih.gov/pubmed/11519183
- 衞藤光明. 環境汚染と病理 環境科学の最前線 メチル水銀中毒症(水俣病)の発症機構について. 日本病理学会会誌 2001; 90: 123.
- 牛島佳代, 北野隆雄,二塚信. メチル水銀汚染地域住民のQOLとソーシャルサポートに関する研究. 日本衛生学雑誌 2000; 55: 188.
- 原口浩一, 遠藤哲也, 阪田正勝, 増田義人,SimmondsMark. 市販鯨肉製品における重金属及び有機塩素系化合物の汚染実態調査. 食品衛生学雑誌 2000; 41: 287-296.
- 原田正純. 世界の環境汚染現場を行く 世界から日本をみる. 日本農村医学会雑誌2000; 48:809-814.
- 藤野糺,崔洪斌. 中国松花江流域住民のメチル水銀汚染の影響に関する臨床疫学的研究. 日中医学 2000; 15: 30.
- 有澤孝吉, 高橋達也, 中野篤浩, 劉暁潔, 齋藤寛, 滝澤行雄,木場隆司. 産業廃棄物処分場周辺地区住民の無機水銀曝露調査 尿中水銀濃度,自覚症状ならびに腎機能. 日本公衆衛生雑誌2000; 47: 134-144. http://www.ncbi.nlm.nih.gov/pubmed/10734728
- 安藤哲夫. 【臨床検査の新しい展開 環境保全への挑戦】 環境問題と疾病 海洋汚染と国際的課題 海洋汚染で測定されている金属類 水銀,スズ. 臨床検査 1999; 43: 1281-1286.
- 牛島佳代, 北野隆雄, 稲岡司, 永野恵,二塚信. メチル水銀汚染地域住民のADL とソーシャルサポートに関する研究. 日本衛生学雑誌 1999; 54: 128.
- 坂本峰至, 中野篤浩,赤木洋勝. メチル水銀汚染は水俣における出生性比に影響を及ぼしたのか?. 日本衛生学雑誌 1999; 54: 130.
- 須山祐之, 高久悟, 村松淳, 大川由一,高橋義一. 歯科診療室からの排水中水銀の実態調査及びその対策. 口腔衛生学会雑誌 1999; 49: 502-503.
- 中川良三, 須永貴文, 金田直樹,渋谷里美. 千葉県における環境土壌中の水銀の動態. 千葉大学環境科学研究報告 1999; 24: 12-16.
別表-4 水銀汚染に関連する論文4(和文)
水銀&小児/幼児/胎児
- 玉川公子. 【小児疾患診療のための病態生理】 神経疾患 胎生期の薬剤,放射線曝露による脳障害. 小児内科 2003; 35: 746-748.
- 諏訪園靖,能川浩二. 【小児疾患診療のための病態生理】 中毒 重金属(鉛,水銀,ヒ素). 小児内科 2003; 35: 1321-1325.
- 村田勝敬, 岩田豊人, 坂本峰至, 仲井邦彦, 岩崎容子, 嶽石美和子, 廣澤巌夫,照井哲. メチル水銀曝露の小児神経行動発達への影響に関する横断的研究. 日本衛生学雑誌 2003; 58: 157.
- 村田勝敬 , 嶽石美和子, 坂本峰至, 仲井邦彦, 岩崎容子, 岩田豊人, 照井哲,PalWeihe,PhilippeGrandjean. メチル水銀曝露の小児聴性脳幹誘発電位(BAEP)潜時影響に関する横断的研究. 日本衛生学雑誌 2003; 58: 156.
- 劉忠民, 仲井邦彦, 黒川修行, 亀尾聡美,佐藤洋. 胎児期メチル水銀曝露による神経行動学的影響に及ぼす離乳後飼育環境の影響. 日本衛生学雑誌 2003; 58: 156.
- 岡知子, 松葉佐正, 岡元美和子, 北野隆雄,二塚信. 胎児性水俣病患者の自律神経機能評価心電図PR間隔の解析. 日本衛生学雑誌 2002; 57: 334.
- 吉田稔. 【重金属中毒学 消滅しない元素の毒科学】 金属の胎盤透過性と胎児への影響 水銀蒸気曝露の場合. 医学のあゆみ 2002; 202: 923-924.
- 窪田真知,松本信一郎. 胎児期乳児期における経母体メチル水銀曝露量評価. 日本産科婦人科学会雑誌 2002; 54: 452.
- 石井好二郎. 口腔温による小児の体温の検討 小児の低体温問題. 日本生気象学会雑誌2002; 39: 25-30.
- 村田勝敬,嶽石美和子. 胎児性メチル水銀曝露による小児神経発達影響 Faroe 研究を中心に.日本衛生学雑誌 2002; 57: 564-570.http://www.ncbi.nlm.nih.gov/pubmed/12385115
- 仲井邦彦,佐藤洋. 【重金属中毒学 消滅しない元素の毒科学】 鉛と水銀,その古くて新しい重金属の中毒学 周産期及び乳幼児期曝露に起因する行動奇形. 医学のあゆみ 2002; 202:891-894.
- 仲井邦彦,佐藤洋. 【内分泌攪乱物質の基礎と臨床】 内分泌攪乱物質の健康影響に関する疫学研究から 周産期曝露の影響を中心として. 最新医学 2002; 57: 229-235.
- 土井陸雄. 胎児性水俣病患者の症状悪化に関する緊急提言 早急に公害健康被害者の健康追跡調査を. 日本公衆衛生雑誌 2002; 49: 73-75.http://www.ncbi.nlm.nih.gov/pubmed/11915316
- 原田正純. 私が水俣病から学んだこと 21 世紀の環境教育への提言. 学校保健研究 2001;42: 470-473.
- 渡辺知保. セレン欠乏と脳機能 メチル水銀毒性におけるその意義. 日本衛生学雑誌 2001;55: 581-589. http://www.ncbi.nlm.nih.gov/pubmed/11265129
- 武藤玲子,大橋博文. 胎児性メチル水銀効果. 日本臨床 2001; 別冊: 688-689. http://www.ncbi.nlm.nih.gov/pubmed/11462635
- 平山紀美子. メチル水銀の代謝動態と胎児への影響. 熊本県母性衛生学会雑誌 2001; 4: 3-8.
- 宮本清香,松本美由紀. 水俣病患者のQOL 向上に関する1 考察. 保健婦雑誌 2000; 56:680-684.
- 原田正純. 【神経症候群V】 各種疾患にみられる神経疾患 奇形症候群 胎児性メチル水銀症候群. 日本臨床 2000; 別冊: 102-104.http://www.ncbi.nlm.nih.gov/pubmed/11057159
- 松井寿夫,渡辺啓太. 【子どもの健康と生活環境】 地球環境 河川・海洋汚染. 小児科2000;41: 76-82.
- 浅山敬, 仲井邦彦, 金忠龍, 劉忠民, 黒川修行, 亀尾聡美,佐藤洋. 胎児期におけるメチル水銀曝露による神経行動学的な影響 マウス胎児期及び成長後の2 回曝露の影響. 日本衛生学雑誌 2000; 55: 190.
- 渡辺知保. セレン欠乏による神経・行動機能への影響とメチル水銀毒性におけるその意義. 日本衛生学雑誌 2000; 55: 81-84.
- 島津恒敏[幸寺]. アトピー性皮膚炎と化学物質 水銀とアトピー性皮膚炎 歯科金属(水銀アマルガム)が小児アトピー性皮膚炎発症に及ぼす影響についての疫学的検討. 皮膚2000; 42:15-21.
- 北條祥子. 医療従事者と環境ホルモン 胎盤を通過する環境ホルモン. ナースデータ 2000;21: 59-64.
- 原田正純. 【環境汚染と周産期】 胎児性水俣病. 周産期医学 1999; 29: 448-452.
- 村尾光治. 霊長類における有機水銀の胎児影響. 日本薬理学雑誌 1999; 114: 76P.
- 藤野糺. 胎児性水俣病多発地区中学生の26 年後の面接による健康調査(続報) 対照地区住民との比較. 九州神経精神医学 1999; 45: 66.
- 高橋好文, 鶴田昌三, 小林正季, 高田明昇, 岩瀬晴彦,長谷川二郎. アマルガム修復物から放出される水銀と母親,胎児の臓器,血液及び尿中水銀量について. 歯科材料・器械 1997; 16:105.