メチル水銀曝露による健康障害に関する国際的レビューに関する研究
村田勝敬(秋田大学大学院医学系研究科環境保健学教授)
吉田 稔(八戸大学人間健康学部教授)
仲井邦彦(東北大学大学院医学系研究科環境保健医学准教授)
坂本峰至(国立水俣病総合研究センター疫学部長)
岩田豊人(秋田大学医学部社会環境医学環境保健学助教)
柳沼 梢(東北大学大学院医学系研究科環境保健医学)
島田美幸(東北大学大学院医学系研究科環境保健医学)
研究要旨
水俣病は発生から50年以上経過して日本でのメチル水銀汚染はもはやないが、自然界から水銀は発生しており、小児における低濃度水銀曝露の健康影響に関する問題は必ずしも全て解決している訳ではない。また、中国、ブラジル、東南アジア、アフリカなどの発展途上国における、特に金採掘による水銀汚染も世界的な問題になっている。このような観点から、低濃度曝露を含む国際的なメチル水銀による健康障害に関する文献レビューを行った。
今年度のレビューにより、以下のことが示された。(1)メチル水銀および水銀を扱ったPubMed掲載論文の中で、2008年以降ヒト研究の報告数が減少傾向にある。(2)メチル水銀の介入研究により、高濃度メチル水銀含有魚を長期間摂食し続けると交感副交感神経バランスに関連する心疾患の潜在的リスクを高める可能性がある。(3)胎児期のメチル水銀およびPCB曝露量および妊娠期間の魚介類摂食量を含めて小児行動発達影響を検討すると、運動機能にメチル水銀が影響している可能性が示唆された。(4)出産前後の母子赤血球中の重金属濃度を測定すると、胎盤経由の母から子どもへの移行は、メチル水銀が最も高く、カドミウムはあまり移行しないと考えられた。一方、ヒ素も有機ヒ素として海産物に多く含まれ、メチル水銀とともにヒ素も魚摂取によって体内に多く取り込まれ、かつ胎盤経由で子どもにも移行した。(5)臍帯組織中メチル水銀濃度を解析すると、水俣病発生時期の水俣地域の曝露濃度はチッソ水俣工場でアセトアルデヒドの生産量が増えた1955~1959年に最も高く、それ以後徐々に低下した。また、水俣近辺の地区別臍帯組織メチル水銀濃度の推移を検討すると、史的事実と一致していた。
途上国の水銀汚染に関しては、小規模金鉱山における採掘活動にともなう作業者の健康被害がアマゾン流域に留まらずアフリカ、東南アジアでも深刻な社会問題となっている。特に、水銀アマルガム燃焼作業者の多くが典型的な慢性水銀中毒症状を呈しており、水銀汚染の影響の大きさが窺える。アマゾン流域では国連工業開発機構の下で水銀による健康被害対策が実施されているが、まだ多くの発展途上国で対策の遅れが目立つ。中国では小規模水銀鉱山作業者に慢性水銀中毒症状が見られている。加えて、水銀採掘活動に伴い周辺地域の土壌の水銀汚染が穀物中のメチル水銀含量の増加を招いていることから、環境からの水銀蒸気曝露に加え、食物からのメチル水銀曝露もあり、複合曝露によるリスクが危惧される。また旧水銀鉱山を抱える地域では水銀による環境への影響をモニタリングする動きも出てきている。
キーワード: メチル水銀、低濃度曝露、胎児期、成人期、発展途上国
Ⅰ.研究目的
日本はメチル水銀汚染による広汎な健康被害を水俣病として経験し、これまでに様々な情報を発信してきた。しかし、近年発展途上国における金採掘に伴うメチル水銀汚染が問題となっている。本稿では、このような状況を鑑み、胎児期および成人期の低濃度メチル水銀曝露や途上国での水銀汚染の実態などを文献的に概観し、日本での健康被害との比較や、日本が行うべき情報の発信、国際協力のあり方について検討することを目的としている。また、わが国ではメチル水銀による健康被害を熟知する専門家の数が年々減少している。したがって、若い研究者にメチル水銀の問題を再認識してもらい、同時に学会やインターネットサイトに発表・掲載することにより、この種の研究の重要性を広く理解してもらうために情報発信する。
本年度は、①メチル水銀の疫学研究のここ10年間の推移を示すとともに、②2010年に日本発の疫学研究論文の概要、③途上国での水銀汚染の実態などメチル水銀(および水銀)曝露による健康影響の実態および研究動向を文献レビューし、その影響や地域の特徴を検討した。
Ⅱ.研究方法
文献データベースMedline (PubMed) を用いて、2010年末までに報告された①メチル水銀に関連する論文数の推移、②日本発の疫学研究論文の概要、③途上国での水銀汚染の実態など、メチル水銀曝露による健康影響に関する文献レビューを行った。
(倫理面への配慮)
本研究は、公開された文献調査であるので、倫理的配慮は必要としない。
Ⅲ.研究結果
1)メチル水銀(および水銀)のヒト研究の推移
メチル水銀(methylmercury)がキーワードとなっている総論文数を2000年から2010年までをPubMedを用いて検索すると(表1)、124編~298編(全言語)であり、このうちヒトを対象とした論文数は1年当たり55編から109編である。2000~2004年までヒトを対象とした研究が4割以上を維持していたが、2005年以降PubMedでの登録雑誌数の増加とともに幾分低率になり、特に2008年以降メチル水銀関連論文に占めるヒト研究は総数および率ともに減少の一途を辿っている。同様に、水銀(mercury)をキーワードとする論文も、2005年以降ヒトを対象とした論文数の割合が減少傾向にある。
1998~2000年にメチル水銀を巡るフェロー諸島出生コホート研究とセイシェル小児発達研究の一大論争があり1-6)、それに伴いメチル水銀のヒト(特に小児)健康影響に関する論文が発表され始めた。また、機を同じくして2002年のNew England Journal of Medicine誌でのメチル水銀の冠状動脈疾患リスクに関連する論争があり7-9)、メチル水銀の問題が世間を騒がせた時期と呼応する。一方、2008年にセイシェル小児発達栄養研究の成果が発表され10, 11)、フェロー諸島とセイシェルのメチル水銀論争の結末が見えるとともにメチル水銀に関する関心が薄れてきたかに思える。
| 西暦年 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | |
| “methylmercury”の入った論文数 | 148 | 145 | 124 | 143 | 159 | 201 | 227 | 298 | 294 | 249 | 267 |
| ヒトを対象とした論文数 | 62 | 59 | 55 | 60 | 74 | 67 | 75 | 106 | 109 | 82 | 75 |
| 割合(%) | 41.9 | 40.7 | 44.4 | 42.0 | 46.5 | 33.3 | 33.0 | 35.6 | 37.1 | 32.9 | 28.0 |
| “mercury”の入った論文数 | 820 | 834 | 931 | 897 | 980 | 1227 | 1320 | 1414 | 1479 | 1403 | 1464 |
| ヒトを対象とした論文数 | 342 | 351 | 366 | 361 | 374 | 398 | 440 | 353 | 493 | 422 | 349 |
| 割合(%) | 41.7 | 42.1 | 39.3 | 40.2 | 38.2 | 32.4 | 33.3 | 32.0 | 33.3 | 30.1 | 23.8 |
2)メチル水銀の介入研究
2006年以降から2010年末までに発表された疫学論文のうち、介入研究(Intervention study)はYaginuma-Sakuraiらの研究1編12)しかない。これまでの介入研究では、メチル水銀の体内動態が検討されてきたが13-16)、メチル水銀摂取によるヒト健康影響まで研究した報告は殆どない。
Yaginuma-Sakuraiらは1973年に日本の厚生省より出された暫定的耐容週間摂取量(PTWI、3.4µg/kg体重/週)相当のメチル水銀をメバチマグロおよびメカジキ(体重60kgの人で約200g/週)を通して被検者27名(平均年齢25歳)に14週間摂食してもらい、またその摂食終了後15週まで毛髪水銀濃度の動態を測定した。この研究では、メチル水銀曝露群とともに、通常の食事を続ける対照群27名(平均年齢24歳)でも同様の測定を行った。この結果を図1に示しているが、曝露群の毛髪水銀濃度は曝露前が2.30µg/g、曝露終了時が8.76µg/g、曝露離脱後が4.90µg/gであった。これに対して、対照群の毛髪水銀濃度は2.1µg/g付近であった。
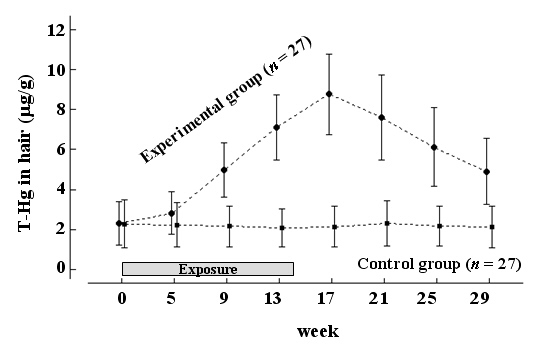
PTWIレベルのメチル水銀曝露による毛髪水銀の上昇率(傾き)は0.54µg/g/週であり、曝露離脱中の下降率(傾き)は -0.33µg/g/週であった。また、摂食したメチル水銀が毛髪に移動するまでの時間的ズレ(time-lag)は3週間と算出され、この値はHislopらの結果17)とほぼ同様の値(約20日)であった。曝露終了後の毛髪水銀の半減期も計算され、図1に一次回帰式を当てはめると約95日であったが、この半減期はAl-ShahristaniとShihab18)がイラクでのメチル水銀中毒禍の患者で計算した値(35~189日、平均72日)と似通っていた。さらに、4週毎に毛髪採取が全員で行われたが、その際、被検者後頭部の同一部位で採取され、54名の平均毛髪発育速度は約1.3cm/4週と計測された。この毛髪発育速度は、アフリカ人や白人の毛髪発育速度1cm/月19, 20)よりも速く、毛髪を生体試料として使う場合には対象集団の毛髪発育速度を確認しておくことも必要となろう。
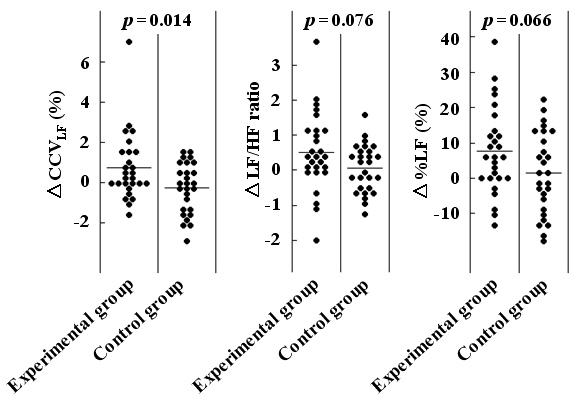
この対象者54名は曝露前(0週)、曝露終了直後(15週)、曝露離脱後(29週)に採血され、多価不飽和脂肪酸(血漿DHA+EPA)濃度が測定され、かつ心拍変動も測定された。対照群ではいずれの値も有意な変動を示さなかったが、曝露群ではDHA+EPA濃度、心拍変動の交感副交感神経バランス(LF/HF比)、交感神経活動比率(%LF)、交感神経成分の心拍変動(CCVLF)が毛髪水銀濃度の変化に伴って有意に変動した。また、メチル水銀曝露終了直後の交感神経活動レベル(曝露前後の差分)は、対照群と比べて、曝露群で有意に大きかった(図2)。Okaらは胎児性水俣病患者で副交感神経活動レベルが有意に低下していたと報告しているが21)、同じ結果と解釈することができる。
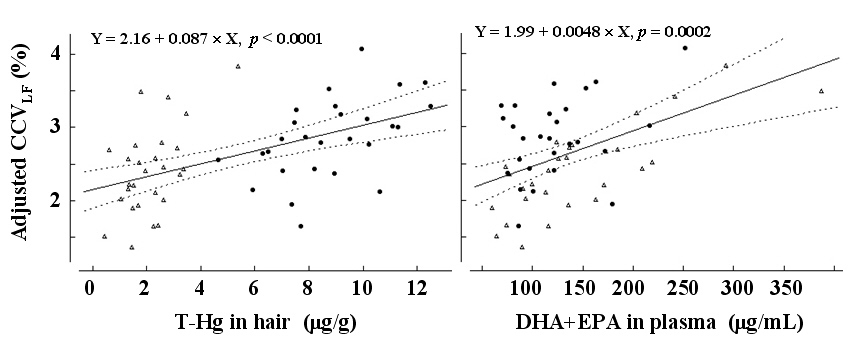
さらに、対象者54名の曝露終了直後の毛髪水銀濃度と性・年齢、肥満度指数(BMI)で調整した交感神経成分の心拍変動(CCVLF)には有意な量依存関係が認められた(図3)。これらのメチル水銀曝露による量依存関係はMurataら22) やGrandjeanら23)の結果とほぼ一致する(但し、Grandjeanらは交感神経および副交感神経活動レベルともにメチル水銀の胎児期曝露によって低下している)。本研究におけるこの種の自律神経機能変動はマグロ摂食による一時的変化と解釈することも可能であるが、PTWIレベルのメチル水銀曝露が成人の健康に対して安全であるということを保証するものではないだろう。すなわち、本研究では14週で摂食を止めているが、その後も摂食を続ければ毛髪水銀濃度がさらに高くなる可能性を示唆している。換言すると、長期のメチル水銀曝露(例えば、毎日マグロを食べている人)は交感副交感神経バランスに関連する心疾患の潜在的リスクを高めることになるかもしれない24)。なお、血漿DHA+EPA濃度と調整後CCVLFと有意な正の関連が認められており(図3)、この関係についてはさらに詳細な検討が今後必要である。また、この介入研究の曝露群においては、さらに毎週(曝露終了後は隔週)採血もされており、毛髪-血液中水銀比率などの動態の解析が検討される予定であり、今後の成果に期待したい。
3)Tohoku Study of Child Development−東北コホート調査
魚多食集団におけるメチル水銀の小児神経発達影響は、これまでフェロー諸島(クジラ)1, 3, 4, 23, 25, 26)、セイシェル(カツオなど)2, 6, 27)およびニュージーランド(サメ)28, 29)の出生コホート研究の報告に頼ってきた。しかしながら、各々の国によって食べる魚も量も違うし、基本的な食生活習慣が異なる。したがって、わが国固有の出生コホート研究の成果発表に期待が寄せられていた。東北コホート調査の研究デザインに関する論文30)が2004年に出されてから6年経過し、2010年に漸くその成果がSuzukiらによって発表された32)。この研究ではセイシェルおよびニュージーランドのコホート研究で測定されなかった臍帯血polychlorinated biphenyls(PCB)も測定されており、神経行動学的検査成績に及ぼすPCBおよびメチル水銀の影響を検討したフェロー諸島出生コホート研究5)に次ぐ快挙と言えよう。
東北コホート調査では、出産時母親毛髪水銀、PCBおよび多価不飽和脂肪酸(DHAやEPA)を反映すると考えられる母親の妊娠期の魚介類摂取量を曝露指標(説明変数)として、ブラゼルトン新生児行動評価(NBAS)に影響する要因を検討した。重要な曝露因子や交絡因子(共変量)を欠いたまま解析した以前の研究と異なり、曝露に関連する要因を全て含んだ研究として評価される。
ブラゼルトン新生児行動評価は、生後3日の新生児498名で行われ、28の行動項目と18の反射項目からなり、7つのクラスターに分けられる31)。出産時の母親毛髪水銀濃度は2.22±1.16µg/g(範囲、0.29~9.35µg/g)であり、この値はセイシェルの母親の平均毛髪水銀6.8µg/gやフェロー諸島の母親の4.3µg/gよりも低かった。また、臍帯血の総PCB濃度は52.4±32.6(7.0~273.8)ng/g脂質であり、Todakaら33)やKawashiroら34)の測定した日本人妊婦の値とほぼ同等であったが、フェロー諸島研究5, 35)の値よりはかなり低かった。臍帯血甲状腺ホルモン(T3)も測定され、総PCB値と有意な相関(r=0.139)が認められた。
ブラゼルトン新生児行動評価の7クラスターのうち、運動クラスターの得点は毛髪水銀および総PCB濃度と有意な単相関(各々、r=-0.126とr=-0.140)を示した。次に、毛髪水銀、総PCB、魚介類摂取量の他に関連する交絡因子を説明変数とし、運動クラスター得点を目的変数とする重回帰分析を行うと、毛髪水銀濃度のみが有意な負の関連を示したが、総PCBは有意な関連性を示さなかった。この結果はフェロー諸島出生コホート研究の結果5)と一致した。すなわち、臍帯組織PCBはボストン語彙検査(Boston Naming Test)および注意集中機能検査(反応時間)の低下と有意に関連したが、水銀濃度を調整するとこれらの有意な関連性は消失した。
PCBの周産期曝露による神経行動/心理学的影響は、多くの疫学研究が行われているものの、必ずしも一定の結論が得られている訳ではない。例えば、米国(ミシガン西部)36)、ドイツ(デュッセルドルフ)37)、オランダ38, 39)におけるコホート研究では小児神経発達にPCBが悪影響を及ぼすことが報告されている。米国ノースカロライナコホートでは、周産期PCB曝露の影響が小児の加齢に伴い変わった40-42)。すなわち、新生児および2歳児では有意な関連があったが、3~5歳児になるとそのような有意な関連は見られなくなった。一方、幾つかのコホート研究では周産期PCB曝露と神経行動指標との間に有意な関係を見つけることができなかった5, 43, 44)。東北コホート調査のPCB濃度が高くなかったということもあるが、メチル水銀曝露の影響を考慮するとPCBの影響は見られない。この結論が確定的であるか否かについては今後の研究動向を追跡していかねばならない。ただ、前述の多くのコホート研究で重要な有害物質(メチル水銀や鉛)の影響を考慮しておらず、このことがPCBの影響評価の結論を先送りしている理由の一つと考えられる。いずれにしても、環境中のメチル水銀、PCB、鉛などの濃度は年々低くなり、妊婦のこれら物質の環境曝露も低下するであろう。このことは、当該物質の曝露による健康影響も益々軽微になっていくことを示唆する。したがって、「低濃度なので同時曝露物質としなかった」1, 2)ではなく、本研究のように吟味していく姿勢が重要となる。
4)母体および臍帯血の水銀と他の化学物質の関係
高度経済成長期に排出された水銀、鉛、カドミウム、ヒ素などの重金属による環境汚染により、人類は健康問題に遭遇した。先進諸国では、今日、これらの化学物質に対して厳しい規制が行われ、公害に相当するような重篤な汚染は発生していないように思われる。にもかかわらず、これらは自然界から地殻ガスとしても発生するので、汚染が皆無になるということはない。その結果、先進諸国では慢性低濃度曝露による健康影響が危惧され続けている19, 45-47)。また、これに伴い、研究の標的集団も成人から子ども、特に胎児へと推移しつつある(次のⅢ-5を参照)。したがって、胎児期の曝露影響を表すと考えられる臍帯血中の重金属濃度の動態を明らかにすることは意義深い。Sakamotoらは、九州福岡県にある産婦人科医院に通院している出産前1週間の妊婦の血液とその出生児の臍帯血(81ペア)を収集し、赤血球中の水銀、鉛、カドミウム、ヒ素、セレン濃度を測定した48)。ここで赤血球中濃度を測定したのは、血清あるいは血漿中水銀は金属水銀あるいは無機水銀の生体曝露指標であるが、赤血球中水銀はメチル水銀の最も良い生体曝露指標とみなされているからである15, 49)。
表2が母子ペア81組から算出された重金属の平均±標準偏差の値である。これらの母子間の値は水銀、鉛、ヒ素およびセレンで正の相関(p<0.01)があり、カドミウムでも正の相関(p<0.05)が見られた(すなわち、母体赤血球濃度が高いほど臍帯血赤血球濃度も高くなる)。また、いずれの重金属も母子間で有意な差が認められ(対応のあるt検定、p<0.01)、水銀とセレンは臍帯血赤血球中濃度の方が母体血赤血球中濃度よりも高かった。このため、臍帯と母体の赤血球中濃度比は水銀とセレンで1より大きくなり、胎児へのこれら金属の胎盤移行度が高いことが推定された。メチル水銀が必須アミノ酸と結合した形で胎児に移行することは過去の報告でも知られていた50, 51)。しかし、セレンについてはSakamotoらの結果48)と同様の報告もあるが52)、逆に臍帯血セレンが母体血セレンよりも低いとする報告もあり53, 54)、人種あるいは食生活の違いによって異なるのか現時点で決定することはできない。一方、カドミウムの胎盤経由の移行はこれら金属の中で最も低く、他の報告53, 55-60)でも同様の結果であった。胎盤でのカドミウム蓄積量が母体血や臍帯血よりも高いことは知られており55, 59, 61)、胎盤がカドミウムに対する障壁として効果的に働いていることを示唆しているのかもしれない。
| Hg | Pb | Cd | As | Se | |
|---|---|---|---|---|---|
| 母体赤血球中濃度 | 9.41±4.19 | 26.4±9.74 | 1.97±0.72 | 6.12±3.40 | 192±25.1 |
| 臍帯赤血球中濃度 | 15.3±7.43 | 13.2±4.12 | 0.22±0.20 | 3.76±2.27 | 227±33.9 |
| 臍帯/母体赤血球比 | 1.63±0.28 | 0.52±0.11 | 0.12±0.08 | 0.62±0.17 | 1.18±0.11 |
体内の金属間の関係を調べると、母体内の水銀が高いと、ヒ素およびセレンも高くなり(各々、r=0.31とr=0.29)、胎児内の水銀が高いとヒ素も高い(r=0.24)48)。このヒ素の多くは有機ヒ素(arsenobetaine)であり62, 63)、海産物の摂食に由来するものである64, 65)。このため、海産物を多食する人ではメチル水銀もヒ素も共に高くなるし、臍帯血で同様の観察が見られても不思議でない。有機ヒ素そのものは毒性が低いと言われているが、体内で無機ヒ素に変わりうる。無機ヒ素の神経毒性は広く知られているので66-68)、今後もメチル水銀、鉛、ヒ素の同時曝露による健康影響(特に、神経発達影響)に注意を向けていく必要がある。
5)水俣地域住民の「臍の緒」のメチル水銀濃度の推移
水俣病は、メチル水銀が高濃度に蓄積された魚介類の摂取によって起きたメチル水銀中毒であり、環境への配慮を欠いた産業活動がもたらした公害の原点である。水俣病の歴史を描いた和書は多数あるが、英文で記された書は必ずしも多くない69-73)。それら歴史書によると、水俣病が発生していた当時の生体試料中の水銀測定法は十分確立されていなかった。このためかメチル水銀の量−反応関係を評価する際、世界の研究者はイラクで発生した農薬によるメチル水銀中毒禍のデータを用い74-76)、曝露データを持たない水俣病の疫学研究を殆ど利用しなかった。水俣病研究を世界に再認識させる契機になったのは保存「臍の緒」から測定されたメチル水銀濃度であり77-79)、この歴史的意義を再評価したのは環境保健領域の先導的雑誌“Environmental Health Perspectives”に2010年に掲載された総説である80)。
1950年代を挟む歴史的時期に熊本県の水俣地域で集められた臍帯組織のメチル水銀濃度の大半は国立水俣病総合研究センターで測定され、同じ臍帯組織メチル水銀データが異なる機関から発表された81, 82)。ここでは、2010年に発表されたSakamotoら82)の報告を紹介する。
| Years | n | Median (µg/g) | 25-75 Percentiles |
|---|---|---|---|
| 1945-1949 | 6 | 0.401 | 0.205-0.747 |
| 1950-1954 | 43 | 0.166 | 0.082-0.539 |
| 1955-1959 | 63 | 0.777 | 0.346-1.680 |
| 1960-1964 | 88 | 0.350 | 0.182-0.715 |
| 1965-1969 | 91 | 0.250 | 0.188-0.400 |
| 1970-1974 | 21 | 0.170 | 0.143-0.330 |
| 1975-1989* | 13 | 0.100 | 0.056-0.190 |
表3は出生が1945~1989年の5年毎の水俣地域全体における臍帯組織中メチル水銀濃度の中央値とその25および75パーセンタイル値である。1955~1959年のメチル水銀の臍帯組織濃度が最も高く、その後徐々に濃度は低下した。
| Population | n | Median (µg/g) | 25-75 Percentiles |
|---|---|---|---|
| Miyazaki | 106 | 0.060 | 0.039-0.068 |
| Akita* | 91 | 0.080 | 0.040-0.133 |
| Tottori* | 45 | 0.098 | 0.062-0.148 |
| Tsushima** | 38 | 0.054 | 0.038-0.072 |
| Fukuoka** | 55 | 0.088 | 0.076-0.121 |
| Tokyo** | 17 | 0.131 | 0.096-0.197 |
表4は比較的最近生まれた対照地域の子どもの臍帯組織のメチル水銀濃度である。出生地が宮崎、秋田、鳥取では保存臍帯(*)、対馬(長崎)、福岡、東京では乾燥臍帯(**)を用いて、メチル水銀濃度が測定された。表3と表4を比較すると、水俣地域でも1975~1989年生まれの子どもの臍帯組織メチル水銀濃度は対照地域の値と殆ど変わらないが、それ以前の臍帯組織からは高濃度のメチル水銀が検出されたことが明らかである。すなわち、1955~1959年に水俣地域で生まれた子どもは対照地域から生まれた子どもの8倍以上も高いメチル水銀の曝露を受けていた。
メチル水銀は胎盤を介して容易に胎児に移行し、胎児に母親よりも高い濃度で蓄積し83)、発達中の胎児の脳に悪影響を及ぼす19, 80)。この胎児期曝露後の小児発達影響を調べる最も優れた生体指標として、National Research Councilは臍帯血水銀を推奨した19)。ただ、臍帯血は母親の妊娠後期の食事内容に影響され易いので、Grandjeanら84)は臍帯組織水銀濃度も胎児期メチル水銀の曝露指標として有用であると述べている。実際、Murataら22)は7歳児の自律神経機能を評価する際に曝露指標として臍帯組織中メチル水銀濃度を用い、両者に有意な関連があったことを報告している。
さらに、Sakamotoらは水俣地域で得られた保存臍帯組織のメチル水銀濃度とともに、チッソ水俣工場のアセトアルデヒドの生産量の年次推移を重ね、アセトアルデヒドの生産量低下に伴い臍帯組織中メチル水銀濃度も低下したことを示した(図4)82)。そして、生産を中止した1968年の翌年以降は1µg/gを超えるメチル水銀濃度は検出されていないと述べた。但し、この調査は悉皆あるいはランダムサンプリング調査でなく、保存臍帯の収集は水俣病患者団体のリーダーに依頼したので、高値を危惧する人たちが多く含まれていた可能性はありうる。一方、典型的胎児性水俣病患者は1名しか含まれていなかった。
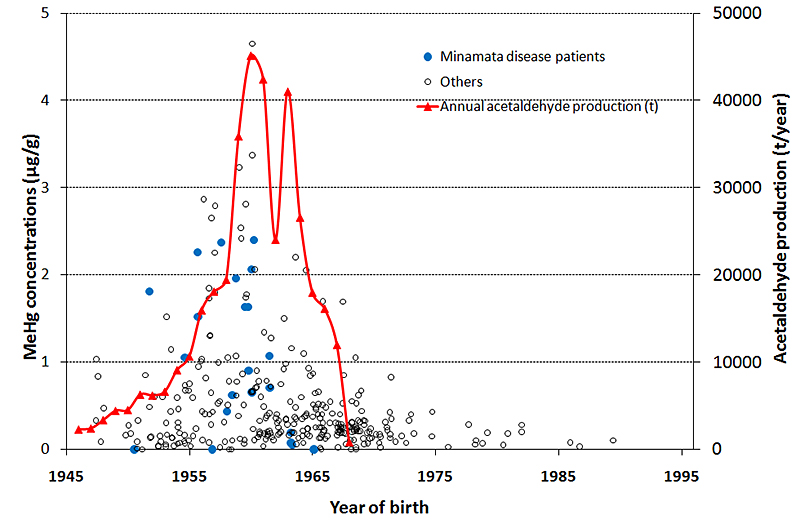
地区別に臍帯組織メチル水銀濃度を検討すると82)、1µg/gを超える濃度は水俣、出水および津奈木の出生児に見られたが、芦北やその他不知火海沿岸では認められなかった。さらに、1µg/gを超える濃度は水俣市で1947~1968年に、出水地区では1953~1967年に、津奈木地区では1956~1961年に観察された。これら時間的空間的な推移は水俣病の歴史に刻まれた事実を裏付けるものと考えられた。
6)発展途上国における水銀の健康問題
多くの発展途上国では小規模金鉱山で金採掘に多量の水銀が使用され、その水銀は回収されないまま環境中に放出されるため、水銀による環境汚染や採掘に携わる作業者やその周辺住民の健康影響が社会的な問題となっている。特に中国貴州省の手掘り採掘を行う水銀鉱山においては、周辺地域の水銀汚染や作業者の健康影響が問題視されている。本章は2010年に発表された論文をもとに小規模金鉱山や水銀鉱山の採掘に伴う最近の水銀汚染とその健康影響について報告する。
①小規模金鉱山における水銀による環境汚染と健康影響
国連工業開発機構(UNIDO)によりタンザニアの小規模金鉱山地区の作業者を対象に健康評価が行われた85)。水銀曝露地区Rwanmagasaで水銀を取扱わない作業者52名、水銀を取扱うが水銀アマルガム燃焼作業を行わない作業者34名、アマルガム燃焼作業者104名、これに対照地区Katoroの住民31名(対照群)を加えて医学的、神経学的、神経心理的検査を実施した。アマルガム燃焼作業者の血液中水銀濃度は平均4.62(0.73~6.06)µg/l、尿中水銀濃度(クレアチニン補正値、Cr)は平均3.55(0.12~36.77)µg/g Crであり、対照群の血液水銀濃度は平均1.05(0.22~2.29)µg/l、尿中水銀濃度は平均0.24(0.04~0.92)µg/g Crと比べかなり高値であった。アマルガム燃焼作業者の25名(約24%)に慢性水銀中毒症状である振戦、流唾過多、運動失調、歯肉の色素沈着、感覚障害が認められている。また、自覚症状として食欲不振、記憶力減退、倦怠感等を有する者の割合が対照群に比べ高く、しかも鉛筆タッピング(p<0.01)やマッチ箱検査(p<0.05)成績も対照群に比べ悪かった。タンザニアの小規模金鉱山におけるアマルガム燃焼者の水銀蒸気による健康影響は深刻であり、さらなる悪化を防止するために水銀曝露の軽減が必要である。
インドネシアでは中央カリマンタン地区と北スラウィシ地区の2つの小規模金鉱山で作業者の健康評価が行われた86)。水銀曝露を受けている地域住民84名(カリマンタン地区66名とスラウィシ地区18名)、水銀による金抽出を行う作業者47名(カリマンタン地区30名とスラウィシ地区17名)、アマルガム燃焼作業者129名(カリマンタン地区69名とスラウィシ地区60名)、これに対照群としてスラウィシ地区住民21名を加えて、医学的、神経学的、神経心理的検査を行った。両地区のアマルガム燃焼作業者の平均血中水銀濃度はカリマンタン地区で38.92(2.01~429)µg/l、スラウィシ地区で27.43(4.55~186)µg/lであり、また平均尿中水銀はカリマンタン地区で69.35(0.72~1697)µg/g Cr、スラウィシ地区で31.89(0.48~231.8)µg/g Crであり、対照群の平均血中水銀濃度4.92(2.36~10.12)µg/l、平均尿中水銀濃度0.43(0.09~1.35)µg/g Crと比べて、高かった。これら作業者には運動失調、振戦、拮抗運動反復不全などの典型的な水銀中毒症状が見られ、カリマンタン地区では62%、スラウィシ地区では55%のアマルガム燃焼作業者が慢性水銀中毒に罹患していた。神経心理学的検査である記憶検査、フロスティッグ視知覚発達検査、マッチ箱検査、鉛筆タッピングの成績は、いずれも対照群と比べ、両地区のアマルガム燃焼者で有意に劣っていた。アマルガム燃焼作業者以外にも鉱山周辺の一般住民にも高い割合(カリマンタン地区で31.8%、スラウィシ地区で16.7%)で中毒症状が見られたことから、一般住民の中毒予防にはアマルガム燃焼による大気中に放出される水銀量を減少させることが重要である。
ガーナ共和国でも小規模金鉱山が全国に遍在している。Yasaswiら87)は Upper-EastにあるTalensi-Nabdam地区の金鉱山作業者120名を対象に健康評価を行った。作業者の1/5以上が尿中水銀値10µg/l以上であり、5%の作業者がWHOガイドラインである50µg/lを上回っていた。特に、アマルガム燃焼作業者5名の尿中水銀値は中央値43.8µg/l、平均171.1(±296.5)µg/lであり、機械操作作業者4名(中央値11.6µg/l)や管理者11名(中央値5.6µg/l)と比べてかなり高値であった。ガーナ共和国では200,000人が小規模金鉱山に従事しており、これらの人々の健康リスクを最小化するために水銀曝露の実態を説明することが重要である。
アメリカのネバダ州にある2つの露天掘り金鉱(Cortez-Pipeline鉱山とTwin Creeks鉱山)には高濃度の水銀を含む鉱物があり、金採掘活動に伴い水銀が放出される。Eckleyら88)は2つの金鉱からの水銀放出量を算出した。捨石集積(0.6~3.5µg Hg/g)からの水銀流出量は<1500 ng/m2/dayであり、尾鉱(2.8~58µg Hg/g)からは684,000 ng/m2/dayであり、しかも水銀流出量は鉱物中の水銀濃度、表面の粒径、含水量と関連していた。最も高い水銀放出は金抽出を行う際のシアン浸出中の鉱物や加工処理した高純度鉱物を含む尾鉱を貯めている水からであった。これらの結果から鉱山敷地の埋め立てや捨石(ズリ)の利用中止などは水銀の放出減少に繋がるようであった。また、Eckleyらは2つの金鉱山で表面から放出される水銀量を鉱物や環境条件を基に計算すると、年間19kgと190kgと推定した89)。これらは各々の鉱山から放出される水銀の56%と14%に相当し、浸出している堆積や尾鉱を貯めている水にある鉱物が主な放出源であり、水銀放出を軽減するためには採掘操作を中断するしかないと示唆した。
②小規模水銀鉱山における水銀による環境汚染と健康影響
中国貴州省には幾つかの水銀鉱山が偏在している。多くは手掘りであり、周辺の環境汚染と作業者の健康影響が危惧される。Liら90)は、濫木廠(Lanmuchang)、銅仁(Tongren)、貴州などの地域で尿および毛髪水銀を測定し、手掘り水銀鉱山作業者の水銀曝露を調査した。Gouxiでは住民13名の尿中水銀濃度の幾何平均が30.6 µg/g Crであるのに対し作業者25名は216 µg/g Crであり、また濫木廠の住民12名は39.2 µg/g Cr、作業者6名は560 µg/g Crであった。いずれの地区でも作業者の尿中水銀は高値であり、しかも臨床症状の手指振戦が3名の作業者(Gouxi地区2名、濫木廠地区1名)で認められた。
さらに、水銀鉱山周辺では食物の水銀汚染が問題視されている91)。濫木廠水銀鉱山地区では土壌中の水銀汚染により穀物や野菜の水銀汚染が発生している。しかも米の中にもメチル水銀が含まれており、この地区の住民は魚介類摂取に依らない米食によるメチル水銀曝露のあることが報告されている。Gouxiと濫木廠の両地区住民の毛髪中メチル水銀濃度を測定すると、Gouxi地区では平均4.26(1.87~10.6)µg/g、濫木廠地区では4.55(2.29~9.55)µg/gであり、しかも毛髪メチル水銀濃度は米のメチル水銀摂取量との間に有意な相関(r=0.73)が認められた。手掘り水銀採掘に伴う水銀汚染は作業者だけでなく住民にも水銀蒸気とメチル水銀の複合曝露による健康リスクの増強を示唆する。また、Liら92)は水銀鉱山周辺で収穫された米のメチル水銀の化学形態を高速液体クロマトグラフィー/誘導結合プラズマ質量分析(ICP-MS)装置を用いて解析した。生の米のメチル水銀の化学形態は血液-脳関門や胎盤関門を通過するときCH3Hg-L-Cysteine型として存在していた。しかし、調理後の米にはCH3Hg-L-Cysteineは検出されず、他の化学形態に変化しているようであるが、その化合物の同定および毒性は不明のままである。
Fangら94)は蕪湖都市周辺(Wuhu urban area)の5地区で土壌中の総水銀と生物学的に利用される水銀分布を調査し、小児に対する健康リスク評価を行った。土壌中水銀は平均0.207 mg/kg(0.024~2.844 mg/kg)であり、塊状に分布し、都心から周辺地区に向けて減少し、人間活動が活発な鏡湖地区では最も高い値(0.332 mg/kg)を示した。土壌中で生物学的に利用される平均水銀量は3.8(2.6~4.9)µg/kgで、総水銀の0.28~6.44%であった。野菜の平均水銀濃度は6.53(2.7~15.2)µg/kgであり、土壌中で生物学的に利用される水銀量と正の相関を示した。また、小児のハザード指数(HQ)を計算すると、土壌からの水銀蒸気の吸入は80.3%と主な曝露経路であることを示すが、HQ値は2.517×10-2であった。しかも、ハザード指標(HI)は安全レベルであるHI=1よりかなり低く、蕪湖都市周辺では土壌由来の水銀曝露による小児への健康リスクは低いことを示唆した。
メキシコには多くの水銀鉱山があり、Guerrero州の北部地帯には4つの水銀鉱山がある。Mariaら95)はこれら水銀鉱山地域に住む12歳以上の女性122名を対象に尿中水銀レベルやその変動を調査し、汚染された土壌からの健康影響の評価を行った。土壌中水銀濃度が625 ppb以上の汚染地域に住む30歳以上の女性の尿中水銀(クレアチン補正値)は汚染が少ない地域の女性より212%も高く、歯科アマルガム充填者よりも120%高かった。この地域の女性の尿中水銀は50 µg/g Cr以上が5%、35 µg/g Cr以上が7%、5 µg/g Cr以上が54%であった。この汚染地区の女性の尿クレアチニン値の平均は0.7(0.1~3.8)g/lであり、汚染が少ない地域の女性の平均0.4(0.1~2.4)g/lより41%も高値である。汚染地区の女性の水銀曝露には歯科アマルガム充填材、雨水、井戸水で洗浄した食物も寄与していることが明らかとなり、鉱山周辺住民の健康影響の保護のためにも採鉱廃棄物の管理が重要である。
近年になり、環境中の高濃度の水銀がヒトや生態系に大きな影響を及ぼすことが示され、旧水銀鉱山から環境中に放出される水銀のモニタリングが行われている。スロベニアの旧イドリア水銀鉱山は500年以上にわたり年間1200万トンの水銀鉱石を産出した。イドリア地方の大気中水銀の発生源、空間分布そして堆積に関する調査が行われた95)。大気中水銀濃度は大半が10 ng/m3以下であったが、旧鉱山の精錬所周辺では5000 ng/m3を超えていた。大気中の水銀蒸気、ガス状無機水銀、粒子状水銀の形態別分析を行うと、ガス状無機水銀と粒子状水銀の割合は1%以下であった。大気中の粒子状水銀は降水量により変動するが、降水中の水銀の大半が粒子性の水銀であった。走査型電子顕微鏡検査では、降水中や降下物中に辰砂が存在しており、これはこの地域の地表面の辰砂が風の侵食作用よって飛散したものであった。
スペインのアストゥリアス地区にはアルマデン水銀鉱山など幾つかの水銀鉱山がある。Loredoら96) はアストゥリアス地区のMieresとPoll de Lena地域の水銀鉱山から廃棄された水銀鉱石の表層水のモニタリングをCaudal川集水域で行った。水銀が鉱化された地域ではヒ素の豊富な黄鉄鉱、鶏冠石、少量の硫砒鉄鉱などを含有しており、捨石集積からの鉱山排水や浸出液には酸性条件下で高濃度のヒ素を含み、Caudal川支流に流れ込んでいた。一方、水銀鉱山地区の川上や川下の表層水中の水銀濃度はいつも0.5 µg/l以下であり、過去の水銀採掘や廃鉱石の風化にも拘わらず、河川は水銀によってあまり汚染されていなかった。
Ⅳ.わが国のメチル水銀影響に関する疫学研究の動向
2000年前後より、わが国でも出生コホート研究が行われるようになり、その先鞭をつけたのは「東北コホート調査」と「環境と子どもの健康に関する北海道スタディ」である。北海道スタディは主に環境化学物質による次世代影響として、①泌尿生殖器系の先天異常、②神経行動発達、③甲状腺機能への影響、④免疫・アレルギー性疾患等に焦点を当てて実施しており、化学物質曝露としては主にダイオキシン類、PCBs、有機フッ素化合物、水銀、妊婦の喫煙などを測定し、研究成果を発表している97-101)。ただ、我々が見落としているだけかもしれないが、水銀影響に関する発表はない。東北コホート調査でも様々な化学物質曝露について検討しているが、常にメチル水銀やPCBs曝露による小児発達影響を睨んでおり、神経発達指標の測定を行える適齢期に合わせて検査を継続している。今回紹介した研究成果12, 31)は発達段階にある一時期に測定された神経発達影響の解析結果であり、これからも徐々に研究成果が出てくることが期待される。さらに、平成23年2月に入ってから環境省「子どもの健康と環境に関する全国調査(エコチル調査)」の15地域ユニットセンターが出生コホートの対象者を本格的に募集し始めた。したがって、今後わが国でもエコチル調査で行われる環境曝露評価(生体試料、食事調査、質問票調査、生活環境測定)と健康影響評価により、環境中の有害化学物質のヒトへの健康影響の全国レベルの実態が明らかにされよう。
水俣病が発生した当時の水俣地域と比べて、メチル水銀の曝露レベルは著明に低下している82)。もっとも低濃度のメチル水銀曝露は、我々が魚摂食を止めない限り、避けられない。今回および以前のレビューを通してメチル水銀のヒトへの健康影響を概観すると、マグロや歯クジラなど高濃度のメチル水銀を含む魚介類を多食し続ける集団で様々な健康影響が見え隠れする12, 23-25)。先進諸国でメチル水銀曝露による臨床症状が観察されたとする報告は近年見られないが1-7)、メチル水銀以外の物質も考慮すると、軽微な無症候性神経影響が現れる10-12, 23-26, 31)。そのような軽微な神経影響は臨床医にとって全く意味を持たないけれど、有害影響の出始める曝露濃度(臨界濃度)の解析や当該物質の発症リスクに関する情報の収集・蓄積は(病気のない人が健康的な生活を送れるようにする)予防医学にとって重要となる。今後の研究はまさに低濃度曝露による健康影響であり、その検出は一層困難を窮めることが予想される。にもかかわらず、有害性が証明されている化学物質の濃度(曝露評価)とともに、ヒトの生体に起こっている些細な有害影響(影響評価)を地道に測定し、解析し、検討していかねばならない。
ダンテの煉獄の山に例えて、環境疫学研究の7つの大罪(高慢、嫉妬、憤怒、怠惰、貪欲、大食、色欲)をGrandjeanが記している102)。彼によると、高慢は方法論への没頭、嫉妬は他者の業績を認識しない、憤怒は競争者への独善的威嚇、怠惰は不公平に対し無神経、貪欲は既得権からの恩恵、大食は出版への過度な切望、色欲は学究的称号に対する願望となる。「疫学的根拠の限界を認めつつも、入手可能な根拠がどのようなものか判ってくると、どの程度のことが本当に明らかにされているのかと疑問を抱くことも必要である」とか「環境保健雑誌に発表される論文の大半が、限られた、むしろ安定した汚染物質(例えば、鉛)を扱っており、他の複雑な名称の汚染物質は全くと言って良いほど研究されていない」など刺激的な文章が綴ってあり、一読するに値する。ただ、メチル水銀が“安定した汚染物質”なのかどうかは後世において評価されよう。
Ⅴ.結論
今年度の文献レビューにより、以下のことが示された。(1)メチル水銀および水銀を扱ったPubMed掲載論文の中で、2008年以降ヒト研究の報告数が減少傾向にある。(2)メチル水銀の介入研究により、高濃度メチル水銀含有魚を長期間摂食し続けると交感副交感神経バランスに関連する心疾患の潜在的リスクを高める可能性がある。(3)胎児期のメチル水銀およびPCB曝露量および妊娠期間の魚介類摂食量を含めて小児行動発達影響を検討すると、運動機能にメチル水銀が影響している可能性が示唆された。(4)出産前後の母子赤血球中の重金属濃度を測定すると、胎盤経由の母から子どもへの移行は、メチル水銀が最も高く、カドミウムは殆ど移行しないと考えられた。一方、ヒ素も有機ヒ素として海産物に多く含まれ、メチル水銀とともにヒ素も魚摂取に比例して体内に多く取り込まれ、かつ胎盤経由で子どもにも移行した。(5)臍帯組織中メチル水銀濃度を解析すると、水俣病発生時期の水俣地域の曝露濃度はチッソ水俣工場でアセトアルデヒドの生産量が増えた1955~1959年に最も(現在と比べ8倍以上)高く、それ以後徐々に低下していた。また、水俣近辺の地区別臍帯組織メチル水銀濃度の推移を検討すると、史的事実と一致していた。
途上国の水銀汚染に関しては、小規模金鉱山における採掘活動にともなう作業者の健康被害がアマゾン流域に留まらずアフリカ、東南アジアでも深刻な社会問題となっている。特に、水銀アマルガム燃焼作業者の多くが典型的な慢性水銀中毒症状を呈しており、水銀汚染の影響の大きさが窺える。アマゾン流域ではUNIDOの下で水銀による健康被害対策が実施されているが、まだ多くの発展途上国で対策の遅れが目立つ。中国では小規模水銀鉱山作業者に慢性水銀中毒症状が見られている。加えて、水銀採掘活動に伴い周辺地域の土壌の水銀汚染が穀物中のメチル水銀含量の増加を招いていることから、環境からの水銀蒸気曝露に加え、食物からのメチル水銀曝露もあり、複合曝露によるリスクが危惧される。また旧水銀鉱山を抱える地域では水銀による環境への影響をモニタリングする動きも出てきている。
Ⅵ.次年度以降の計画
メチル水銀曝露は低濃度でも小児の神経発達に影響することが多くの論文で示されている。一方で鉛、ヒ素、マンガンなどの化学物質も神経毒性があることが知られており、これらのメチル水銀との同時曝露による神経発達影響に関する研究が今後なされていくと考えられる。したがって、2011年に発表される論文の中で、このような内容を含む論文を選択的に収集し、その中でメチル水銀がどのように評価されているのか検討したい。
引用文献
- Grandjean P, Weihe P, White RF, Debes F, Araki S, Yokoyama K, Murata K, Sørensen N, Dahl R, Jørgensen PJ. Cognitive deficit in 7-year-old children with prenatal exposure to methylmercury. Neurotoxicol Teratol 1997; 19: 417-428. http://www.ncbi.nlm.nih.gov/pubmed/9392777
- Davidson PW, Myers GJ, Cox C, Axtell C, Shamlaye C, Sloane-Reeves J, Cernichiari E, Needham L, Choi A, Wang Y, Berlin M, Clarkson TW. Effects of prenatal and postnatal methylmercury exposure from fish consumption on neurodevelopment: outcomes at 66 months of age in the Seychelles child development study. JAMA 1998; 280: 701-707. http://www.ncbi.nlm.nih.gov/pubmed/9728641
- Murata K, Weihe P, Araki S, Budtz-Jørgensen E, Grandjean P. Evoked potentials in Faroese children prenatally exposed to methylmercury. Neurotoxicol Teratol 1999; 21: 471-472. http://www.ncbi.nlm.nih.gov/pubmed/10440491
- Sørensen N, Murata K, Budtz-Jørgensen E, Weihe P, Grandjean P. Prenatal methylmercury exposure as a cardiovascular risk factor at seven years of age. Epidemiology 1999; 10: 370-375. http://www.ncbi.nlm.nih.gov/pubmed/10401870
- Grandjean P, Weihe P, Burse VW, Needham LL, Storr-Hansen E, Heinzow B, Debes F, Murata K, Simonsen H, Ellefsen P, Budtz-Jørgensen E, Keiding N, White RF. Neurobehavioral deficits associated with PCB in 7-year-old children prenatally exposed to seafood neurotoxicants. Neurotoxicol Teratol 2001; 23: 305-317. http://www.ncbi.nlm.nih.gov/pubmed/11485834
- Myers GJ, Davidson PW, Cox C, Shamlaye CF, Palumbo D, Cernichiari E, Sloane-Reeves J, Wilding GE, Kost J, Huang LS, Clarkson TW. Prenatal methylmercury exposure from ocean fish consumption in the Seychelles child development study. Lancet 2003; 361: 1686-1692. http://www.ncbi.nlm.nih.gov/pubmed/12767734
- Salonen JT, Seppanen K, Nyyssonen K, Korpela H, Kauhanen J, Kantola M, Tuomilehto J, Esterbauer HH, Tatzber F, Salonen R. Intake of mercury from fish, lipid peroxidation, and the risk of myocardial infarction and coronary, cardiovascular, and any death in eastern Finnish men. Circulation 1995; 91: 645-655. http://www.ncbi.nlm.nih.gov/pubmed/7828289
- Guallar E, Sanz-Gallardo MI, vant Veer PV, Bode P, Aro A, Gomez-Aracena J, Kark JD, Riemersma RA, Martin-Moreno JM, Kok FJ. Mercury, fish oils, and the risk of myocardial infarction. N Engl J Med 2002; 347: 1747-1754. http://www.ncbi.nlm.nih.gov/pubmed/12456850
- Yoshizawa K, Rimm EB, Morris JS, Spate VL, Hsieh CC, Spiegelman D, Stampfer MJ, Willett WC. Mercury and the risk of coronary heart disease in men. N Engl J Med 2002; 247: 1755-1760. http://www.ncbi.nlm.nih.gov/pubmed/12456851
- Davidson PW, Strain JJ, Myers GJ, Thurston SW, Bonham MP, Shamlaye CF, Stokes-Riner A, Wallace JM, Robson PJ, Duffy EM, Georger LA, Sloane-Reeves J, Cernichiari E, Canfield RL, Cox C, Huang LS, Janciuras J, Clarkson TW. Neurodevelopmental effects of maternal nutritional status and exposure to methylmercury from eating fish during pregnancy. Neurotoxicology 2008; 29: 767-775. http://www.ncbi.nlm.nih.gov/pubmed/18590763
- Strain JJ, Davidson PW, Bonham MP, Duffy EM, Stokes-Riner A, Thurston SW, Wallace JM, Robson PJ, Shamlaye CF, Georger LA, Sloane-Reeves J, Cernichiari E, Canfield RL, Cox C, Huang LS, Janciuras J, Myers GJ, Clarkson TW. Associations of maternal long-chain polyunsaturated fatty acids, methyl mercury, and infant development in the Seychelles child development nutrition study. Neurotoxicology 2008; 29: 776-782. http://www.ncbi.nlm.nih.gov/pubmed/18590765
- Yaginuma-Sakurai K, Murata K, Shimada M, Nakai K, Kurokawa N, Kameo S, Satoh H. Intervention study on cardiac autonomic nervous effects of methylmercury from seafood. Neurotoxicol Teratol 2010; 32: 240-245. http://www.ncbi.nlm.nih.gov/pubmed/19732823
- Miettinen JK, Rahola T, Hattura T, Rissanen K, Tillander M. Elimination of 203Hg-methylmercury in man. Ann Clin Res 1971; 3: 116-122. http://www.ncbi.nlm.nih.gov/pubmed/4997252
- Birke G, Johnels AG, Plantin LO, Sjostrand B, Skerfving S, Westermark T. Studies on humans exposed to methylmercury through fish consumption. Arch Environ Health 1972; 25: 77-91. http://www.ncbi.nlm.nih.gov/pubmed/5045067
- Kershaw TG, Clarkson TW, Dhahir PH. The relationship between blood levels and dose of methylmercury in man. Arch Environ Health 1980; 35: 28-36. http://www.ncbi.nlm.nih.gov/pubmed/7189107
- Sherlock J, Hislop J, Newton D, Topping G, Whittle K. Elevation of mercury in human blood from controlled chronic ingestion of methylmercury in fish. Hum Toxicol 1984; 3: 117-131. http://www.ncbi.nlm.nih.gov/pubmed/6724592
- Hislop JS, Collier TR, White GF, Khathing DT, French E. The use of keratinized tissues to monitor the detailed exposure of man to methyl mercury from fish. In: Chemical Toxicology and Clinical Chemistry of Metals, New York: Academic Press, 1983; pp. 145-148.
- Al-Shahristani H, Shihab KM. Variation of biological half-life of methylmercury in man. Arch Environ Health 1974; 28: 342-344. http://www.ncbi.nlm.nih.gov/pubmed/4829091
- National Research Council. Toxicological Effects of Methylmercury. Washington DC: National Academy Press, 2000.
- Mergler D, Anderson HA, Chan LH, Mahaffey KR, Murray M, Sakamoto M, Stern AH. Mehtylmercury exposure and health effects in humans: a worldwide concern. Ambio 2007; 36: 3-11. http://www.ncbi.nlm.nih.gov/pubmed/17408186
- Oka T, Matsukura M, Okamoto M, Harada N, Kitano T, Miike T, Futatsuka M. Autonomic nervous functions in fetal type Minamata disease patients: assessment of heart rate variability. Tohoku J Exp Med 2002; 198: 215-221. http://www.ncbi.nlm.nih.gov/pubmed/12630553
- Murata K, Sakamoto M, Nakai K, Dakeishi M, Iwata T, Liu XJ, Satoh H. Subclinical effects of prenatal methylmercury exposure on cardiac autonomic function in Japanese children. Int Arch Occup Environ Health 2006; 79: 379-386. http://www.ncbi.nlm.nih.gov/pubmed/16365750
- Grandjean P, Murata K, Budtz-Jørgensen E, Weihe P. Cardiac autonomic activity in methylmercury neurotoxicity: 14-year follow-up of a Faroese birth cohort. J Pediatr 2004; 144: 169-176. http://www.ncbi.nlm.nih.gov/pubmed/14760255
- Choi AL, Weihe P, Budtz-Jørgensen E, Jørgensen PJ, Salonen JT, Tuomainen TP, Murata K, Nielsen HP, Petersen MS, Askham J, Grandjean P. Methylmercury exposure and adverse cardiovascular effects in Faroese whaling men. Environ Health Perspect 2008; 117: 367-372. http://www.ncbi.nlm.nih.gov/pubmed/19337510
- Murata K, Weihe P, Budtz-Jørgensen E, Jørgensen PJ, Grandjean P. Delayed brainstem auditory evoked potential latencies in 14-year-old children exposed to methylmercury. J Pediatr 2004; 144: 177-183. http://www.ncbi.nlm.nih.gov/pubmed/14760257
- Debes F, Budtz-Jørgensen E, Weihe P, White RF, Grandjean P. Impact of prenatal methylmercury exposure on neurobehavioral function at age 14 years. Neurotoxicol Teratol 2006; 28: 536-547. http://www.ncbi.nlm.nih.gov/pubmed/17067778
- Crump KS, van Landingham C, Shamlaye C, Cox C, Davidson PW, Myers GJ, Clarkson TW. Benchmark concentrations for methylmercury obtained from the Seychelles child development study. Environ Health Perspect 2000; 108: 257-263. http://www.ncbi.nlm.nih.gov/pubmed/10706533
- Kjellström T, Kennedy P, Wallis S. Physical and mental development of children with prenatal exposure to mercury from fish. Stage 2, interviews and psychological tests at age 6 (Report 3642). Stockholm: National Swedish environmental Protection Board, 1989.
- Crump KS, Kjellström T, Shipp AM, Silvers A, Stewart A. Influence of prenatal mercury exposure upon scholastic and psychological test performance: benchmark analysis of a New Zealand cohort. Risk Anal 1998; 18: 701-713. http://www.ncbi.nlm.nih.gov/pubmed/9972579
- Nakai K, Suzuki K, Oka T, Murata K, Sakamoto M, Okamura K, Hosokawa T, Sakai T, Nakamura T, Saito Y, Kurokawa N, Kameo S, Satoh H. The Tohoku study of child development: a cohort study of effects of perinatal exposures to methylmercury and environmentally persistent organic pollutants on neurobehavioral development in Japanese children. Tohoku J Exp Med 2004; 202: 227-237. http://www.ncbi.nlm.nih.gov/pubmed/15065649
- Suzuki K, Nakai K, Sugawara T, Nakamura T, Ohba T, Shimada M, Hosokawa T, Okamura K, Sakai T, Kurokawa N, Murata K, Satoh C, Satoh H. Neurobehavioral effects of prenatal exposure to methylmercury and PCBs, and seafood intake: neonatal behavioral assessment scale results of Tohoku study of child development. Environ Res 2010; 110: 699-704. http://www.ncbi.nlm.nih.gov/pubmed/20673887
- Brazelton TB, Nugent JK. Neonatal Behavioral Assessment Scale 3rd ed. London: Mac Keith Press, 1995.
- Todaka T, Hori T, Hirakawa H, Kajiwara J, Yasutake D, Onozuka D, Kato S, Sasaki S, Nakajima S, Saijo Y, Sata F, Kishi R, Iida T, Furue M. Congener-specific analysis of non-dioxin-like polychlorinated biphenyls in blood collected from 195 pregnant women in Sapporo City, Japan. Chemosphere 2008; 73: 923-931. http://www.ncbi.nlm.nih.gov/pubmed/18718631
- Kawashiro Y, Fukata H, Omori-Inoue M, Kubonoya K, Jotaki T, Takigami H, Sakai S, Mori C. Perinatal exposure to brominated flame retardants and polychlorinated biphenyls in Japan. Endocrine J 2008; 55: 1071-1084. http://www.ncbi.nlm.nih.gov/pubmed/18719292
- Longnecker MP, Wolff MS, Gladen BC, Brock JW, Grandjean P, Jacobson JL, Korrick SA, Rogan WJ, Weisglas-Kuperus N, hertz-Picciotto I, Ayotte P, Stewart P, Winneke G, Charles MJ, Jacobson SW, Dewailly E, Boersma ER, Altshul LM, Heinzow B, Pagano JJ, Jensen AA. Comparison of polychlorinated biphenyl levels across studies of human neurodevelopment. Environ Health Perspect 2003; 111: 65-70. http://www.ncbi.nlm.nih.gov/pubmed/12515680
- Jacobson JL, Jacobson SW. Intellectual impairment in children exposed to polychlorinated biphenyls in utero. N Engl J Med 1996; 335: 783-789. http://www.ncbi.nlm.nih.gov/pubmed/8703183
- Winneke G, Bucholski A, Heinzow B, Kramer U, Schmidt E, Walkowiak J, Wiener JA, Steingruber HJ. Developmental neurotoxicity of polychlorinated biphenyls (PCBs): cognitive and psychomotor functions in 7-month old children. Toxicol Lett 1998; 102-103: 423-428. http://www.ncbi.nlm.nih.gov/pubmed/10022290
- Huisman M, Koopman-Esseboom C, Fidler V, Hadders-Algra M, van der Paauw CG, Tuinstra LG, Weisglas-Kuperus N, Sauer PJ, Touwen BC, Boersma ER. Perinatal exposure to polychlorinated biphenyls and dioxins and its effect on neonatal neurological development. Early Hum Dev 1995; 41: 111-127. http://www.ncbi.nlm.nih.gov/pubmed/7601016
- Patandin S, Lanting CI, Mulder PG, Boersma ER, Sauer PJ, Weisglas-Kuperus N. Effects of environmental exposure to polychlorinated biphenyls and dioxins on cognitive abilities in Dutch children at 42 months of age. J Pediatr 1999; 134: 33-41. http://www.ncbi.nlm.nih.gov/pubmed/9880446
- Rogan WJ, Gladen BC, McKinney JD, Carreras N, Hardy P, Thullen J, Tinglestad J, Tully M. Neonatal effects of transplacental exposure to PCBs and DDE. J Pediatr 1986; 109: 335-341. http://www.ncbi.nlm.nih.gov/pubmed/3090217
- Rogan WJ, Gladen BC. PCBs, DDE, and child development at 18 and 24 months. Ann Epidemiol 1991; 1: 407-413. http://www.ncbi.nlm.nih.gov/pubmed/1669521
- Rogan WJ, Gladen BC. Neurotoxicology of PCBs and related compounds. Neurotoxicology 1992; 13: 27-35. http://www.ncbi.nlm.nih.gov/pubmed/1508429
- Daniels JL, Longnecker MP, Klebanoff MA, Gray KA, Brock JW, Zhou H, Chen Z, Needham LL. Prenatal exposure to low-level polychlorinated biphenyls in relation to mental and motor development at 8 months. Am J Epidemiol 2003; 157: 485-492. http://www.ncbi.nlm.nih.gov/pubmed/12631537
- Despres C, Beuter A, Richer F, Poitras K, Veilleux A, Ayotte P, Dewailly E, Saint-Amour D, Muckle G. Neuromotor functions in Inuit preschool children exposed to Pb, PCBs, and Hg. Neurotoxicol Teratol 2005; 27: 245-257.http://www.ncbi.nlm.nih.gov/pubmed/15734276
- Tsuji JS, Benson R, Schoof RA, Hook GC. Health effect levels for risk assessment of childhood exposure to arsenic. Regul TOxicol Pharmacol 2004; 39: 99-110. http://www.ncbi.nlm.nih.gov/pubmed/15041143
- Akesson A, Bjellerup P, Lundh T, Lidfeldt J, Nerbrand C, Samsioe G, Skerfving S, Vahter M. Cadmium-induced effects on bone in a population-based study of women. Environ Health Perspect 2006; 114: 830-834. http://www.ncbi.nlm.nih.gov/pubmed/16759980
- Chen A, Cai B, Dietrich KN, Radcliffe J, Rogan WJ. Lead exposure, IQ, and behavior in urban 5- to 7-year-olds: does lead affect behavior only by lowering IQ? Pediatrics 2007; 119: e650-658. http://www.ncbi.nlm.nih.gov/pubmed/17332184
- Sakamoto M, Murata K, Kubota M, Nakai K, Satoh H. Mercury and heavy metal profiles of maternal and umbilical cord RBCs in Japanese population. Ecotoxicol Environ Safe 2010; 73: 1-6. http://www.ncbi.nlm.nih.gov/pubmed/19819550
- Svensson BG, Schutz A, Nilsson A, Akesson I, Akesson B, Skerfving S. Fish as a source of exposure to mercury and selenium. Sci Total Environ 1992; 126: 61-74. http://www.ncbi.nlm.nih.gov/pubmed/1439752
- Aschner M, Clarkson TW. Distribution of mercury 203 in pregnant rats and their fetuses following systemic infusions with thiol-containing amino acids and glutathione during late gestation. Teratology 1988; 38: 145-155. http://www.ncbi.nlm.nih.gov/pubmed/3175948
- Kajiwara Y, Yasutake A, Adachi T, Hirayama K. Methylmercury transport across the placenta via neutral amino acid carrier. Arch Toxicol 1996; 70: 310-314. http://www.ncbi.nlm.nih.gov/pubmed/8852703
- Kantola M, Purkunen R, Kroger P, Tooming A, Juravskaja J, Pasanen M, Seppanen K Saarikoski S, Vartiainen T. Selenium in pregnancy: is selenium an active defective ion against environmental chemical stress? Environ Res 2004; 96: 51-61. http://www.ncbi.nlm.nih.gov/pubmed/15261784
- Osman K, Akesson A, Berglund M, Bremme K, Schutz A, Ask K, Vahter M. Toxic and essential elements in placentas of Swedish women. Clin Biochem 2000; 33: 131-138. http://www.ncbi.nlm.nih.gov/pubmed/10751591
- Al-Saleh E, Nandakumaran M, Al-Shammari M, Al-Harouny A. Assessment of maternal-fetal status of some essential trace elements in pregnant women in late gestation: relationship with birth weight and placental weight. J Matern Fetal Neonatal Med 2004; 16: 9-14. http://www.ncbi.nlm.nih.gov/pubmed/15370076
- Tsuchiya H, Mitani K, Kodama K, Nakata T. Placental transfer of heavy metals in normal pregnant Japanese women. Arch Environ Health 1984; 39: 11-17. http://www.ncbi.nlm.nih.gov/pubmed/6712281
- Korpela H, Loueniva R, Yrjanheikki E, Kauppila A. Lead and cadmium concentrations in maternal and umbilical cord blood, amniotic fluid, placenta, and amniotic membranes. Am J Obstet Gynecol 1986; 155: 1086-1089. http://www.ncbi.nlm.nih.gov/pubmed/3777054
- Soong YK, Tseng R, Liu C, Lin PW. Lead, cadmium, arsenic, and mercury levels in maternal and fetal cord blood. J Formos Med Assoc 1991; 90: 59-65. http://www.ncbi.nlm.nih.gov/pubmed/1679111
- Plockinger B, Dadak C, Meisinger V. Lead, mercury and cadmium in newborn infants and their mothers. Z Geburtshilfe Perinatol 1993; 197: 104-107. http://www.ncbi.nlm.nih.gov/pubmed/8328167
- Baranowska I. Lead and cadmium in human placentas and maternal and neonatal blood (in a heavily polluted area) measured by graphite furnace atomic absorption spectrometry. Occup Environ Med 1995; 52: 229-232. http://www.ncbi.nlm.nih.gov/pubmed/7795737
- Iyengar GV, Rapp A. Human placenta as a ‘dual’ biomarker for monitoring fetal and maternal environment with special reference to potentially toxic trace elements. Part 1: physiology, function and sampling of placenta for elemental characterization. Sci Total Environ 2001; 280: 195-206. http://www.ncbi.nlm.nih.gov/pubmed/11763267
- Breen JG, Eisenmann C, horowitz S, Miller RK. Cell-specific increases in metallothionein expression in the human placenta perfused with cadmium. Reprod Toxicol 1944; 8: 297-306. http://www.ncbi.nlm.nih.gov/pubmed/7949755
- Mandal BK, Ogra Y, Anzai K, Suzuki KT. Speciation of arsenic in biological samples. Toxicol Appl Pharmacol 2004; 198: 307-318. http://www.ncbi.nlm.nih.gov/pubmed/15276410
- Sakurai T, Kojima C, Ochiai M, Ohta T, Fujiwara K. Evaluation of in vivo acute immunotoxicity of a major organic arsenic compound arsenobetaine in seafood. Int Immunopharmacol 2004; 4: 179-184. http://www.ncbi.nlm.nih.gov/pubmed/14996409
- Yeh CF, Jiang SJ. Speciation of arsenic compounds in fish and oyster tissues by capillary electrophoresis-inductively coupled plasma-mass spectrometry. Electrophoresis 2005; 26: 1615-1621. http://www.ncbi.nlm.nih.gov/pubmed/15759302
- Uneyama C, Toda M, Yamamoto M, Morikawa K. Arsenic in various foods: cumulative data. Food Addit Contam 2007; 24: 447-534. http://www.ncbi.nlm.nih.gov/pubmed/17487664
- Wasserman GA, Liu X, Parvez F, Ahsan H, Factor-Litvak P, van Geen A, Slavkovich V, Lolacono NJ, Cheng Z, Hussain I, Momotaj H, Graziano JH. Water arsenic exposure and children’s intellectual function in Araihazar, Bangladesh. Environ Health Perspect 2004; 112: 1329-1333. http://www.ncbi.nlm.nih.gov/pubmed/15345348
- Dakeishi M, Murata K, Grandjean P. Long-term consequences of arsenic poisoning during infancy due to contaminated milk powder. Environ Health 2006; 5: 31. http://www.ncbi.nlm.nih.gov/pubmed/17076881
- Wang SX, Wang ZH, Cheng XT, Li J, Sang ZP, Zhang XD, Han LL, Qiao XY, Wu ZM, Wang ZQ. Arsenic and fluoride exposure in drinking water: children’s IQ and growth in Shanyin county, Shanxi province, China. Environ Health Perspect 2007; 115: 643-647. http://www.ncbi.nlm.nih.gov/pubmed/17450237
- Kurland LT, Faro SN, Siedler H. Minamata disease. World Neurology 1960; 1: 370-395. http://www.ncbi.nlm.nih.gov/pubmed/13755288
- Igata A. Epidemiological and clinical features of Minamata disease. Environ Res 1993; 63: 157-169. http://www.ncbi.nlm.nih.gov/pubmed/8404770
- Watanabe C, Satoh H. Evolution of our understanding of methylmercury as a health threat. Environ Health Perspect 1996; 104(Suppl 2): 367-379. http://www.ncbi.nlm.nih.gov/pubmed/9182044
- Social Scientific Study Group on Minamata Disease. In the Hope of Avoiding Repetition of a Tragedy of Minamata Disease: What We Have Learned from the Experience. Kumamoto: National Institute for Minamata Disease, 2001.
- Murata K, Sakamoto M. Minamata disease. In: Nriagu J (Editor), Encyclopedia of Environmental Health. Amsterdam: Elsevier, (in press).
- Bakir F, Damluji SF, Amin-Zaki L, Murtadha M, Khalidi A, al-Rawi NY, Tikriti S, Dahahir HI, Clarkson TW, Smith JC, Doherty RA. Methylmercury poisoning in Iraq. Science 1973; 181: 230-241. http://www.ncbi.nlm.nih.gov/pubmed/4719063
- Marsh DO, Clarkson TW, Cox C, Myers GJ, Amin-Zaki L, Al-Tikriti S. Fetal methylmercury poisoning: relationship between concentration in single strands of maternal hair and child effects. Arch Neurol 1987; 44: 1017-1022. http://www.ncbi.nlm.nih.gov/pubmed/2443112
- Cox C, Clarkson TW, Marsh DO, Amin-Zaki L, Tikriti S, Myers GG. Dose-response analysis of infants prenatally exposed to methyl mercury: an application of a single compartment model to single-strand hair analysis. Environ Res 1989; 49: 318-332. http://www.ncbi.nlm.nih.gov/pubmed/2473897
- Nishigaki S, Harada M. Methylmercury and selenium in umbilical cords of inhabitants of the Minamata area. Nature 1975; 258(5533): 324-325. http://www.ncbi.nlm.nih.gov/pubmed/1196356
- Akagi H, Grandjean P, Takizawa Y, Weihe P. Methylmercury dose estimation from umbilical cord concentrations in patients with Minamata disease. Environ Res 1998; 77: 98-103. http://www.ncbi.nlm.nih.gov/pubmed/9600802
- Harada M, Akagi H, Tsuda T, Kizaki T, Ohno H. Methylmercury level in umbilical cords from patients with congenital Minamata disease. Sci Total Environ 1999; 234: 59-62. http://www.ncbi.nlm.nih.gov/pubmed/10507148
- Grandjean P, Satoh H, Murata K, Eto K. Adverse effects of methylmercury: environmental health research implications. Enviorn Health Perspect 2010; 118: 1137-1145. http://www.ncbi.nlm.nih.gov/pubmed/20529764
- Yorifuji T, Kashima S, Tsuda T, Harada M. What has methylmercury in umbilical cords told us?-Minamata disease. Sci Total Environ 2009; 408: 272-276. http://www.ncbi.nlm.nih.gov/pubmed/19878970
- Sakamoto M, Murata K, Tsuruta K, Miyamoto K, Akagi H. Retrospective study on temporal and regional variations of methylmercury concentrations in preserved umbilical cords collected from inhabitants of the Minamata area, Japan. Ecotoxicol Environ Safe 2010; 73: 1144-1149. http://www.ncbi.nlm.nih.gov/pubmed/20494441
- Murata K, Dakeishi M, Shimada M, Satoh H. Assessment of intrauterine methylmercury exposure affecting child development: messages from the newborn. Tohoku J Exp Med 2007; 213: 187-202. http://www.ncbi.nlm.nih.gov/pubmed/17984616
- Grandjean P, Budtz-Jørgensen E, Jørgensen PJ, Weihe P. Umbilical cord mercury concentration as biomarker of prenatal exposure to methylmercury. Environ Health Perspect 2005; 113: 905-908. http://www.ncbi.nlm.nih.gov/pubmed/16002381
- Bose-O'Reilly S, Drasch G, Beinhoff C, Tesha A, Drasch K, Roider G, Taylor H, Appleton D, Siebert U. Health assessment of artisanal gold miners in Tanzania. Sci Total Environ. 2010; 408: 796-805.http://www.ncbi.nlm.nih.gov/pubmed/19945738
- Bose-O'Reilly S, Drasch G, Beinhoff C, Rodrigues-Filho S, Roider G, Lettmeier B, Maydl A, Maydl S, Siebert U. Health assessment of artisanal gold miners in Indonesia. Sci Total Environ. 2010; 408: 713-725. http://www.ncbi.nlm.nih.gov/pubmed/19945736
- Paruchuri Y, Siuniak A, Johnson N, Levin E, Mitchell K, Goodrich JM, Renne EP, Basu N. Occupational and environmental mercury exposure among small-scale gold miners in the Talensi-Nabdam District of Ghana's Upper East region. Sci Total Environ 2010; 408: 6079-6085. http://www.ncbi.nlm.nih.gov/pubmed/20875913
- Eckley CS, Gustin M, Marsik F, Miller MB. Measurement of surface mercury fluxes at active industrial gold mines in Nevada (USA). Sci Total Environ 2011; 409: 514-522. http://www.ncbi.nlm.nih.gov/pubmed/21078520
- Eckley CS, Gustin M, Miller MB, Marsik F. Scaling non-point-source mercury emissions from two active industrial gold mines: influential variable and annual emission estimates. Environ Sci Technol 2011; 45: 392-399. http://www.ncbi.nlm.nih.gov/pubmed/21142061
- Li P, Feng X, Shang L, Qiu G, Meng B, Zhang H, Guo Y, Liang P. Human co-exposure to mercury vapor and methylmercury in artisanal mercury mining areas, Guizhou, China. Ecotoxicol Environ Safe 2010 Nov 4; [Epub ahead of print]. http://www.ncbi.nlm.nih.gov/pubmed/21056470
- Li P, Feng X, Qiu G, Shang L, Li G. Human hair mercury levels in the Wanshan mercury mining area, Guizhou Province, China. Environ Geochem Health 2009 Jan 22; [Epub ahead of print]. http://www.ncbi.nlm.nih.gov/pubmed/19160059
- Li L, Wang F, Meng B, Lemes M, Feng X, Jiang G. Speciation of methylmercury in rice grown from a mercury mining area. Environ Pollut 2010; 158: 3103-3107. http://www.ncbi.nlm.nih.gov/pubmed/20656392
- Fang F, Wang H, Lin Y. Spatial distribution, bioavailability, and health risk assessment of soil Hg in Wuhu urban area, China. Environ Monit Assess 2010 Oct 27; [Epub ahead of print]. http://www.ncbi.nlm.nih.gov/pubmed/20976550
- de Lourdes Soto-Ríos M, Rothenberg SJ, Juárez-Pérez CA, Aguilar-Madrid G. Variability of mercury in urine among Mexican women residing in a mining area. J Occup Environ Med 2010; 52: 62-66. http://www.ncbi.nlm.nih.gov/pubmed/20042876
- Kocman D, Vreča P, Fajon V, Horvat M. Atmospheric distribution and deposition of mercury in the Idrija Hg mine region, Slovenia. Environ Res 2011; 111: 1-9. http://www.ncbi.nlm.nih.gov/pubmed/21112585
- Loredo J, Petit-Domínguez MD, Ordóñez A, Galán MP, Fernández-Martínez R, Alvarez R, Rucandio MI. Surface water monitoring in the mercury mining district of Asturias (Spain). J Hazard Mater 2010; 176: 323-332. http://www.ncbi.nlm.nih.gov/pubmed/20005627
- Sasaki S, Kondo T, Sata F, Saijo Y, Katoh S, Nakajima S, Ishizuka M, Fujita S, Kishi R. Maternal smoking during pregnancy and genetic polymorphisms in the Ah receptor, CYP1A1 and GSTM1 affect infant birth size in Japanese subjects. Mol Hum Reprod 2006; 12: 77-83. http://www.ncbi.nlm.nih.gov/pubmed/16481407
- Sata F, Yamada H, Suzuki K, Saijo Y, Yamada T, Minakami H, Kishi R. Functional maternal catechol-O-methyltransferase polymorphism and fetal growth restriction. Pharmacogenet Genomics 2006; 16: 775-781. http://www.ncbi.nlm.nih.gov/pubmed/17047485
- Sasaki S, Sata F, Katoh S, Saijo Y, Nakajima S, Washino N, Konishi K, Ban S, Ishizuka M, Kishi R. Adverse birth outcomes associated with maternal smoking and polymorphisms in the N-Nitrosamine-metabolizing enzyme genes NQO1 and CYP2E1. Am J Epidemiol 2008; 167: 719-726. http://www.ncbi.nlm.nih.gov/pubmed/18218609
- Washino N, Saijo Y, Sasaki S, Kato S, Ban S, Konishi K, Ito R, Nakata A, Iwasaki Y, Saito K, Nakazawa H, Kishi R. Correlations between prenatal exposure to perfluorinated chemicals and reduced fetal growth. Environ Health Perspect 2009; 117: 660-667. http://www.ncbi.nlm.nih.gov/pubmed/19440508
- Konishi K, Sasaki S, Kato S, Ban S, Washino N, Kajiwara J, Todaka T, Hirakawa H, Hori T, Yasutake D, Kishi R. Prenatal exposure to PCDDs/PCDFs and dioxin-like PCBs in relation to birth weight. Environ Res 2009; 109: 906-913. http://www.ncbi.nlm.nih.gov/pubmed/19683226
- Grandjean P. Seven deadly sins of environmental epidemiology and the virtues of precaution. Epidemiology 2008; 19: 158-162. http://www.ncbi.nlm.nih.gov/pubmed/18091423